| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
Die von Niels Bohr 1913 entwickelte Theorie über das Wasserstoffatom läßt sich mit gutem Willen auch auf andere Atome übertragen. Hierdurch werden zwar nicht alle Phänomene lückenlos geklärt, doch um den Kern der Sache zu verstehen ist sie völlig ausreichend.
Das Wasserstoffatom besteht aus einem Elektron und einem Atomkern, der nur ein
Proton enthält.
Nach der Bohrschen Theorie gilt folgendes:
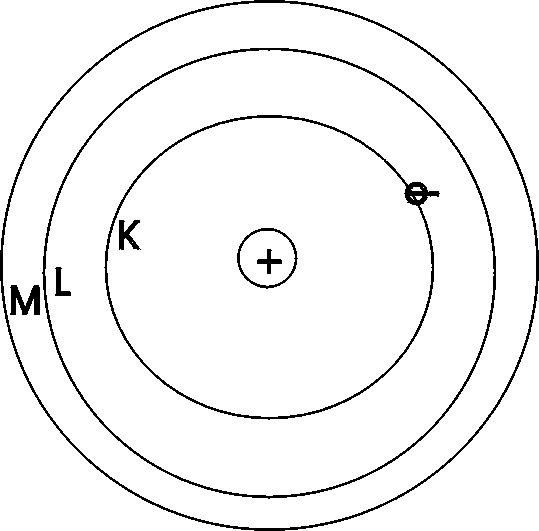
1.) Das Elektron des H-Atoms kann sich nur auf bestimmten Kreisbahnen aufhalten (diese Bahnen werden auch Energieniveaus oder Schalen genannt). Die Bahnen sind konzentrisch um den Atomkern angeordnet. Jede Bahn wird mit einem Buchstaben (K ,L ,M ,N...) oder einer Zahl (n = 1, 2, 3, 4..) bezeichnet.

2.) Für jede Bahn, auf der das Elektron den Atomkern umkreist, hat das Elektron eine bestimmte Energie. Auf der Schale, die dem Atomkern am nächsten ist (K- Schale, n = 1), besitzt das Elektron die geringste Energie. Um das Elektron auf eine weiter außen liegende Bahn zu bringen, muß ihm Energie zugeführt werden, da Arbeit gegen die elektrostatische Anziehungskraft zwischen positiv geladenem Kern und negativ geladenem Elektron geleistet werden muß. Die Energie eines Elektrons darf keine Werte annehmen, die es auf einen Ort zwischen den erlaubten Bahnen bringen würde.
3.) Wenn das Elektron sich auf der innersten Bahn befindet und somit die geringste Energie hat befindet sich das Atom im Grundzustand. Durch Zufuhr von Energie kann das Elektron auf eine größere Bahn springen und somit einen höheren Energiezustand annehmen; dieses ist der angeregte Zustand.
4.) Wenn das Elektron von einem angeregten Zustand auf eine weiter innen liegende Bahn springt, wird ein bestimmter Betrag an Energie freigesetzt und in Form eines Lichtquant emittiert („Bsp.: Neonröhre, die durch Strom leuchtet"). Der Energiebetrag entspricht der Differenz der Energien des höheren und des niedrigeren Energiezustands. Dem abgegebenen Lichtquant entspricht eine bestimmte Frequenz (für jedes Atom verschieden), dies führt zu einer charakteristischen Spektrallinie.
Dieser theoretische Ansatz, daß die Elektronen sich auf konzentrischen Bahnen bewegen und den positiv geladenen Kern umkreisen, läßt sich auf alle Atome übertragen auch die Energiezustände des einzelnen Wasserstoff-Elektrons lassen sich mit einzelne Elektronenübergänge größerer Atome vergleichen.
Die Elemente mit den Ordnungszahlen 58 bis 71 stehen als Fußnote unter den anderen Elementen. Sie werden Lanthanoide oder seltene Erden genannt. Sie gehören eigentlich in die sechste Periode zwischen Lanthan (Z = 57) und Hafnium (Z = 72). Wegen der besseren Übersichtlichkeit stehen sie als Fußnote. Das gleiche gilt für die Actinoiden sie müßten eigentlich in die siebte Periode zwischen Actinium (Z = 89) und Unnilquadium (Z = 104).
Zur Numerierung der Gruppen sind leider mehrere Bezeichnungsweisen in Gebrauch. Wir benutzen die allgemein in Deutschland übliche Form der römischen Nummer mit Angabe ob Haupt- oder Nebengruppe.
Bsp.:
Kohlenstoff ( C ) steht in der IV. Hauptgruppe.
Titan (Ti) steht in der IV. Nebengruppe.
Für einige Gruppen des Periodensystems haben sich historisch eigene Namen gebildet.
| Name | Hauptgruppennummer |
|---|---|
| Edelgase | 0 |
| Alkalimetalle | I |
| Erdalkalimetalle | II |
| Chalkogene | VI |
| Halogene | VII |
Eine Stufenleiter trennt die Metalle von den Nichtmetallen. Metalle zeichnen sich durch metallischen Glanz, Verformbarkeit und hohe Leitfähigkeit für Elektrizität und Wärme aus. Die Grenzlinie zu den Nichtmetallen ist nicht scharf. Die Elemente an der Grenzlinie werden Halbmetalle oder Metalloide genannt; ihre Eigenschaften liegen zwischen denen von Metallen und Nichtmetalle.
Desweiteren sind auf dem Periodensystem nützliche Daten angegeben. Die Ordnungszahl, das chemische Symbol, die Atommasse, der Schmelzpunkt, der Siedepunkt, die Größe und die Elektronegativität eines jeden Elementes.
| Element | Elektronenzahl | Schale | Periode |
|---|---|---|---|
| H | 1 | K | I |
| He | 2 | K | 0 |
| Li | 3 | L | I |
| Be | 4 | L | II |
| B | 5 | L | III |
| C | 6 | L | IV |
| Ar | 18 | M | 0 |
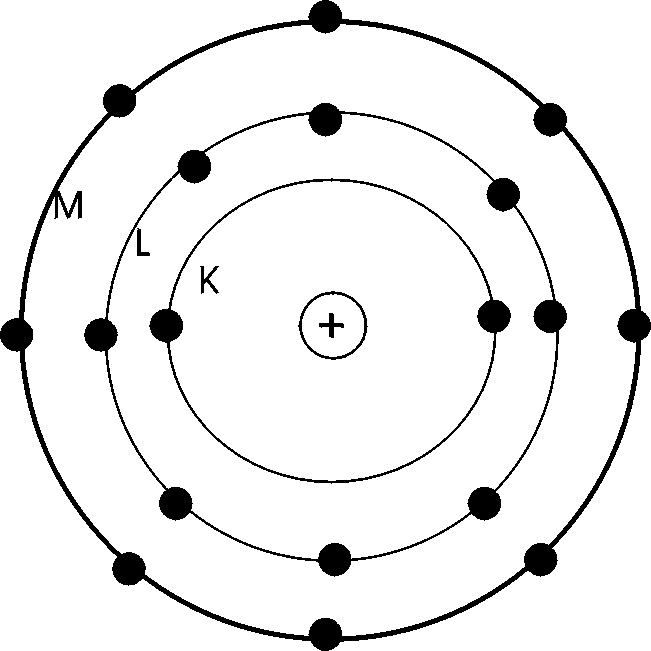
Die Außenschale der Atome wird auch Valenzschale genannt, ihre Elektronen heißen Valenz-Elektronen. Für die Elemente der Hauptgruppen ist die Zahl der Valenzelektronen gleich der Gruppennummer. Die Edelgase (I H) haben immer acht Valenzelektronen, ausgenommen Helium, bei dem sind es zwei.
Edelgase: Sie stehen am Ende einer jeden Periode in der Gruppe Null. Sie bilden farblose, einatomige Gase und sind chemisch gar nicht oder nur unter extremen Bedingungen zur Reaktion zu bewegen. Ihre Elektronenkonfiguration ist besonders stabil, man spricht deswegen auch von Edelgaskonfiguration.
Hauptgruppenelemente: Zu diesen Elementen gehören sowohl Metalle als auch Nichtmetalle, und sie sind in ihrem chemischen und physikalischem Verhalten sehr unterschiedlich Die chemischen Eigenschaften werden von den Valenzelektronen bestimmt.
Nebengruppenelemente: Bei diesen Elementen ist das nach dem Aufbauprinzip zuletzt hinzugekommene Elektron ein Elektron einer inneren Schale. Alle Elemente dieser Gruppe sind Metalle. Die chemischen Eigenschaften hängen von den zwei äußeren Schalen ab.
Lanthanoide und Actinoide: Das nach dem Aufbauprinzip zuletzt hinzugekommene Elektron besetzt eine Stelle in der zweitletzten Schale. Auch diese Elemente sind sämtlich Metalle. Die chemischen Eigenschaften hängen von den drei letzten Schalen ab.
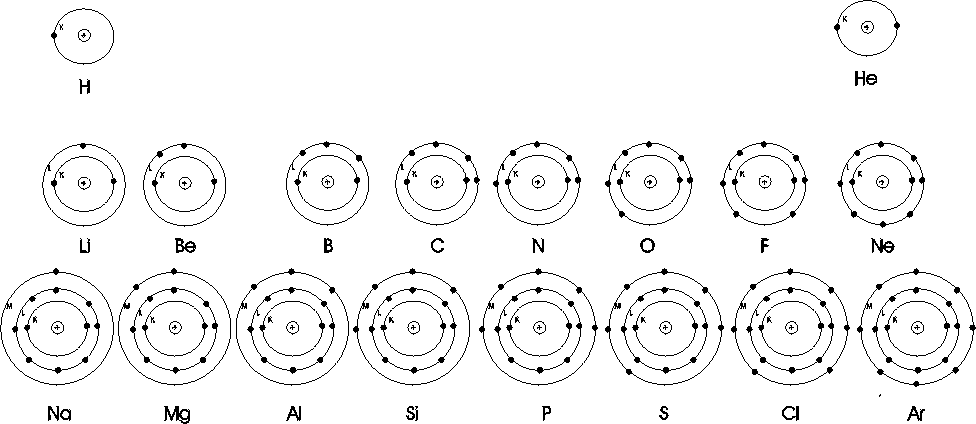
Die Elektronenkonfiguration der Elemente der 1., 2. und 3. Periode:
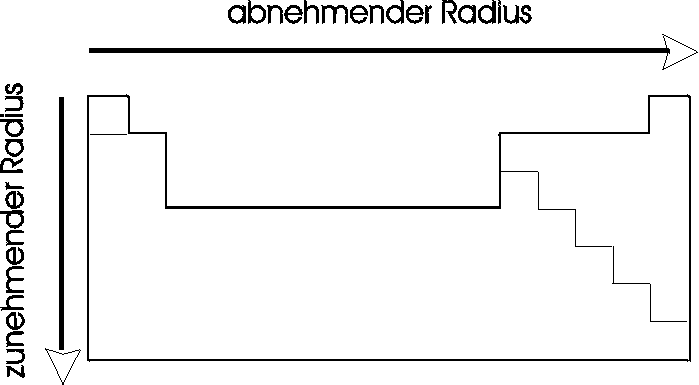
Vergleicht man die Kovalenzradien der Elemente des Periodensystems untereinander, so erkennt man zweierlei Tendenzen:
1.) Innerhalb einer Gruppe nimmt die Größe mit zunehmender Ordnungszahl zu.
Die Zunahme ist leicht verständlich, von einem Element zum nächsten in einer Gruppe kommt jeweils eine Elektronenschale hinzu. Allerdings bedeutet eine Zunahme der Ordnungszahl auch eine Zunahme der positiven Ladungen im Kern, welche die Elektronenhülle zunehmend anzieht und damit eine abnehmende Atomgröße hervorrufen sollte. Die äußeren Elektronen sind allerdings nicht der vollen Kernladung ausgesetzt, die zwischen ihnen und dem Kern befindlichen Elektronen schirmen sie ab.
2.) Bei den Hauptgruppenelementen nehmen die Kovalenzradien innerhalb einer Periode von links nach rechts ab.
Innerhalb einer Periode kommt von Atom zu Atom je ein Elektron zur gleichen Schale hinzu, bei gleichzeitiger Erhöhung der Kernladung. Elektronen in den gleichen Schalen bewirken kaum eine Abschirmung gegenüber der Kernladung. Die zunehmende Kernladung bewirkt eine Schrumpfung der Elektronenwolke innerhalb einer Periode.
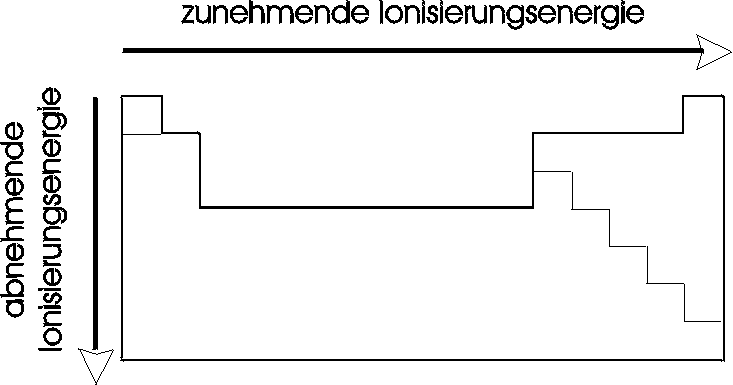
Auch hier erkennt man folge Tendenzen innerhalb des Periodensystems:
1.) Allgemein nimmt die Ionisierungsenergie innerhalb einer Periode von links nach rechts zu.
Die Wegnahme eines Elektrons wird immer schwieriger, weil die Atome kleiner werden (s.o.) und die Kernladung zunimmt.
2.) Allgemein nimmt die Ionisierungsenergie innerhalb einer Hauptgruppe mit zunehmender Ordnungszahl ab.
Die Atomgröße nimmt zu, das zu entfernende Elektron entstammt von Element zu Element einer zunehmend weiter außen liegenden Schale. Das Entfernen wird dadurch immer leichter, da die Kernladung nicht mehr so stark wirksam ist.
Mit einigen Ausnahmen kann man auch hier eine Tendenz innerhalb des Periodensystems feststellen:
1.) Innerhalb einer Periode wird die Elektronenaffinität von links nach rechts größer.
Bei kleinen Atomkernen ist das Elektron dem Atomkern näher und wird somit stärker angezogen.
2.) In allen Perioden ist das Element mit der größten Elektronegativität ein Element der 7. Hauptgruppe (Halogene).
Diesen Elementen fehlt genau ein Elektron um eine stabile Edelgaskonfiguration zu erreichen.
![]()
Da das Natriumatom ein Elektron verloren hat und nur noch über 10 Elektronen verfügt, während der Kern nach wie vor 11 Protonen enthält, hat das Natriumion eine positive Ladung (1+). Im Chloridion sind 18 Elektronen und 17 Protonen enthalten, es hat eine negative Ladung (1-). Bei der Reaktion ist die Zahl der vom Natrium abgegebenen Elektronen gleich der vom Chlor aufgenommenen. In der resultierenden Verbindung sind Na+ und Cl- Ionen im Verhältnis 1:1 vorhanden. Sie ordnen sich spontan zu einem Ionenkristall.
Im Natriumchlorid-Kristall gehört kein Ion exklusiv zu einem anderen Ion. Jedes Natriumion ist von sechs Chloridionen umgeben und jedes Chloridion von sechs Natriumionen. Die Zahl der nächsten Nachbarionen um ein Ion herum nennt man die Koordinationszahl. Da die nächsten Nachbarionen eines Ions immer entgegengesetzt geladen sind, überwiegen im Ionenkristall die Anziehungskräfte gegenüber den abstoßenden Kräften. Die Gesamtanziehung hält den Kristall zusammen und ist die eigentliche Urasche der Ionenbindung.
Das Na+-Ion hat die gleiche Elektronenkonfiguration wie ein Neonatom und das Cl--
Ion hat die gleiche Konfiguration wie ein Argonatom.
Hauptgruppenelemente nehmen in der Regel Elektronen auf oder geben sie ab,
wobei Ionen entstehen, die Elektronenkonfiguration der Edelgase besitzen.
Entweder zwei Elektronen in der äußersten Schale (wie Helium) oder acht
Elektronen (Ne, Ar, Kr, Xe, Rn), was auch als Edelgaskonfiguration bezeichnet
wird.
Bei der Reaktion von Natrium mit Sauerstoff werden pro Atom Sauerstoff 2 Atome Natrium gebraucht, damit die Zahl der vom Na abgegebenen und der vom O aufgenommenen Elektronen übereinstimmt.
![]()