| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
Bei chemischen Reaktionen wird Energie aufgenommen oder abgegeben. Prozesse
bei denen Energie frei wird, können selbständig ohne weitere Energiezufuhr
ablaufen; wenn sie einmal in Gang gekommen sind; Prozesse die Energie
benötigen, müssen ständig mit dieser Energie gespeist werden.
Berechnungen mit den fraglichen Energiewerten sind ebenso von Bedeutung wie die
Berechnung der umgesetzten Stoffmassen.
Die freigesetzte oder aufgenommene Energie kann in verschiedenen Formen in
Erscheinung treten: als Licht, als mechanische- oder elektrische-Energie und vor
allem als Wärme-Energie.
Wenn auf einen Körper der Masse m eine Kraft ausgeübt wird, so wird er in Bewegung gesetzt und beschleunigt. Beim Beschleunigen des Körpers wird Arbeit geleistet. Die Arbeit ist definiert als das Produkt der wirkenden Kraft mal der Weglänge, die vom Körper aufgrund der Krafteinwirkung zurückgelegt wurde.
Energie ist die Fähigkeit Arbeit zu leisten. Nachdem ein Körper auf eine
Geschwindigkeit beschleunigt wurde verfügt er über (kinetische) Energie. Hiermit
kann wieder Arbeit geleistet werden, wenn der Körper gegen eine Kraft wirkt und
dabei verzögert wird (z.B.: Aufprall auf eine andere Kugel). Die dabei geleistete
Arbeit ist genauso groß wie die Arbeit, die beim anfänglichen Beschleunigen der
Kugel geleistet wurde.
Energie kann von einer Form in die andere umgewandelt werden, sie kann aber nie
erzeugt oder vernichtet werden.
Wärme ist eine Energie, die in jedem Körper in unterschiedlicher Menge enthalten sein kann. Zwischen zwei Körpern die sich berühren fließt Wärme, wenn die Körper unterschiedliche Temperatur haben. Die Temperatur ist lediglich ein Maß dafür, in welche Richtung die Wärme fließt.

Jeder Stoff hat in sich Energie in irgendeiner Form gespeichert, sie wird die
innere Energie (U) genannt.
Wenn eine chemische Reaktion abläuft werden die inneren Energien der beteiligten
Stoffe verändert. Es kann Energie frei werden oder sie muß aufgenommen werden.
Die Differenz der inneren Energien der Edukte und der Produkte wird
Reaktionsenergie genannt.
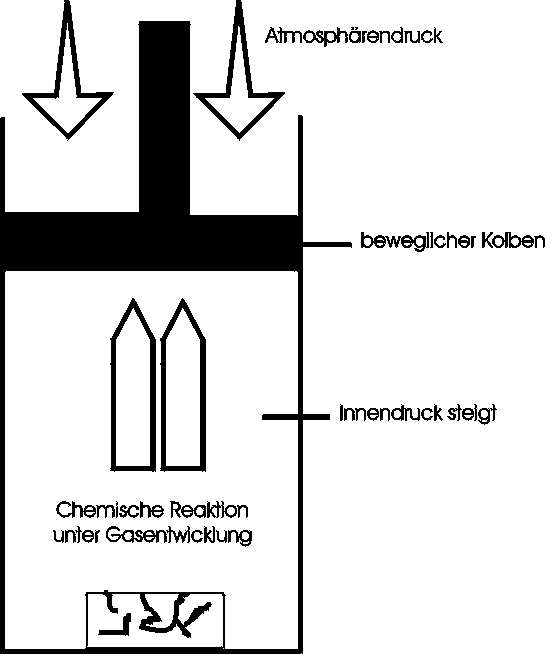
Die meisten chemischen Reaktionen werden in offenen Gefäßen durchgeführt. Wenn dabei Volumenarbeit geleistet wird, kann diese nicht mehr als Wärmeenergie anfallen, d.h. freigesetzte Reaktionsenergie teilt sich auf Volumenarbeit und einen restlichen, als Wärme erhältlichen Energieanteil auf. Dieser restliche Anteil wird Reaktionswärme (Reaktionsenthalpie, Wärmetönung) genannt. Sein Symbol ist deltaH.
Reaktionen bei denen Wärme freigesetzt wird, heißen exotherme Reaktionen, für sie hat deltaH ein negatives Vorzeichen. Endotherme Reaktionen benötigen die Zufuhr von Energie, deltaH hat ein positives Vorzeichen.
Die Energiewerte chemischer Substanzen hängen von der Temperatur, dem Druck und dem Aggregatzustand ab. Durch Übereinkunft werden sie auf Normalbedingungen bezogen.
Wenn die Energiewerte einer chemischen Reaktion und ihrer Verbindungen bekannt sind, kann berechnet werden ob und wieviel Energie in eine Reaktion hineingesteckt werden muß um ein bestimmtes Produkt zu erhalten oder ob man aus einer Reaktion Energie gewinnen kann.
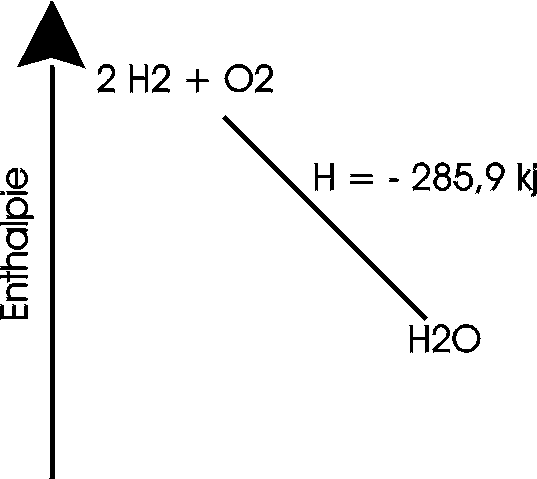
Enthalpie Diagramm für eine exotherme Reaktion
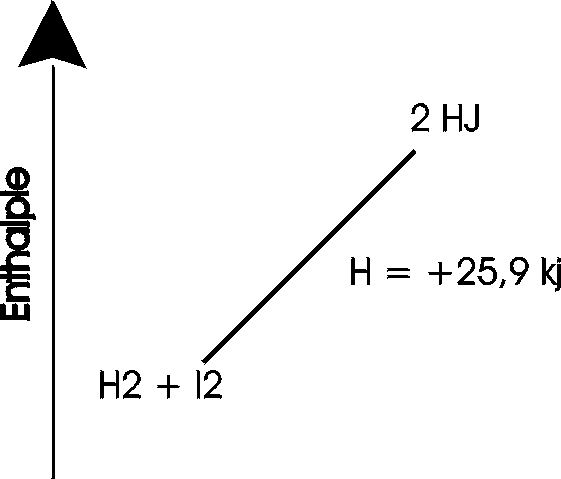
Enthalpie-Diagramm für eine endotherme Reaktion
H-H --> 2 H ergibt deltaH = + 435 kj/mol
Cl-Cl --> 2 Cl ergibt deltaH = + 243 kj/mol
Die deltaH-Werte sind positiv, das Aufbrechen der Bindungen erfordert die Zufuhr von Energie. Werden zwei Atome zu einem Molekül zusammengefügt, so wird der entsprechende Energiebetrag freigesetzt.