
| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
Bei weiterer Abkühlung nimmt die kinetische Energie der Moleküle weiter ab und die
Flüssigkeit erstarrt schließlich zu einem Feststoff. Im Feststoff nehmen die Moleküle
feste Positionen im Raum ein, ihre Bewegung beschränkt sich auf Schwingungen um
diese fixierten Positionen.
In einem Feststoff dominiert der Einfluß der Anziehungskräfte, die kinetische
Energie der Teilchen kann sie nicht überwinden. Er nimmt dadurch kristalline
Strukturen an.
Dipolkräfte:
Aufgrund unterschiedlicher Elektronegativitäten zweier Atome die ein Molekül
bilden, sind die Bindungselektronen nicht gleichmäßig um die beiden Atomkerne
verteilt, sonder befinden sich öfter (näher) an dem Atom mit der höheren
Elektronegativität. Dadurch bilden sich kleine Ladungsunterschiede innerhalb des
Moleküls. Das Atom mit der niedrigeren Elektronegativität erhält dadurch eine
positive Teilladung (δ+(delta)) und das Atom mit der höheren Elektronegativität erhält eine
negative Teilladung (δ-).
Moleküle mit Teilladungen ziehen sich untereinander an wie kleine Magnete.
Verantwortlich hierfür sind vor allem freie Elektronenpaare, wie sie der Sauerstoff im Wassermolekül aufweist.

Der Sauerstoff im Wassermolekül hat sogar zwei davon und erhält deswegen eine
zweifach negative Teilladung (δ2-).
Die beiden Wasserstoffatome sind im Vergleich zum Sauerstoff schwach
elektronegativ, daher befinden sich ihre Elektronen näher am Sauerstoffatom, als
am eigentlichen Ursprungskern (H-Atom). Ihnen wird daher jeweils eine positive
Teilladung (δ+) zugesprochen.
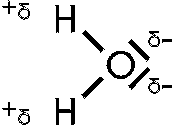
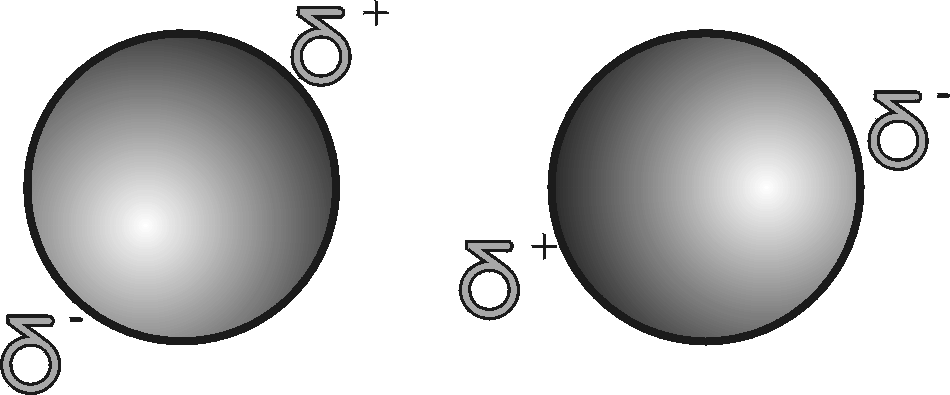
Dipolkräfte wirken zwischen polaren Molekülen. Moleküle dieser Art besitzen ein Dipolmoment und ordnen sich in einem elektrischen Feld. Dipolkräfte werden durch die elektrostatischen Wechselwirkungen zwischen den negativen und positiven Polen der Dipole hervorgerufen.
Das Wasserstoffatom eines Moleküls und ein einsames Elektronenpaar am elektronegativen Atom eines anderen Moleküls ziehen sich gegenseitig an und bilden eine Wasserstoffbrücke. Dieser Bindungstyp, von z.B. HF-, H2O- und NH3- Molekülen über Wasserstoffbrücken werden in Formelbildern durch punktierte Linien zum Ausdruck gebracht.
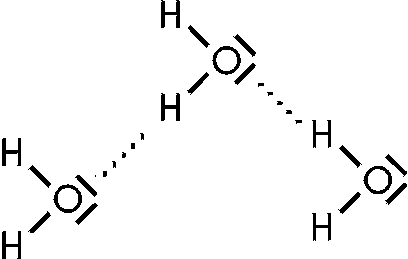
Diese Wasserstoffbrücken haben auf die Moleküle eine auffällige Wirkung. So erhöht sich der Siedepunkt stark gegenüber Molekülen die ähnlich gebaut aber keine Wasserstoffbrücken (H-Brücken) haben. H-Brücken erschweren das Abtrennen einzelner Moleküle aus der Flüssigkeit. Auch hohe Schmelzpunkte und eine hohe Viskosität sind zu finden.
Weitere Eigenschaften des Wassers werden in sonst ungewohntem Ausmaß von H- Brücken beeinflußt. Im Eis werden die Wassermoleküle über H-Brücken zusammengehalten, wobei jedes Sauerstoffatom von vier Wasserstoffatomen umgeben ist. Diese Anordnung führt im Eiskristall zu relativ großen Hohlräumen. Deshalb hat Eis eine geringere Dichte als flüssiges Wasser (Eis schwimmt!). Beim Schmelzen fallen die Hohlräume wieder zusammen. Auch in flüssigem Zustand werden die H2O-Moleküle über H-Brücken zusammengehalten, jedoch in geringerem Ausmaß und weniger starr als im Eis.
Die außerordentlich hohe Löslichkeit einiger Sauerstoff-, Stickstoff- und Fluor- Verbindungen in Wasser (wasserstoffhaltige Lösungsmittel) hängt mit Wasserstoffbrücken zusammen. Ammoniak (NH3) und Methanol (H3COH) lösen sich in Wasser unter Ausbildung von H-Brücken. Entsprechendes gilt für einige sauerstoffhaltige Ionen.
Wasserstoffbrücken sind von zentraler Bedeutung für die Strukturen von Molekülen in der belebten Natur. Proteine und die DNA erhalten ihre dreidimensionale Gestalt unter anderem durch Wasserstoffbrücken.
Die Moleküle in einer Flüssigkeit bewegen sich langsam genug, um von den zwischenmolekularen Anziehungskräften in einem definierten Volumen zusammengehalten zu werden. Die Bewegung ist jedoch zu schnell, um die Moleküle an einem Platz festzuhalten. Eine Flüssigkeit beansprucht dementsprechend zwar ein bestimmtes Volumen, behält aber ihre Form nicht; sie nimmt immer die Form ihres Behälters an.
Eine Druckänderung hat nur einen geringen Einfluß auf das Volumen einer
Flüssigkeit, da die Moleküle aneinander hängen und kaum Platz zwischen ihnen
besteht.
Temperaturerhöhung bewirkt bei den meisten Flüssigkeiten eine
Volumenvergrößerung und damit eine Verringerung der Dichte (g/cm3).
Wenn die Temperatur erhöht wird, nimmt die mittlere kinetische Energie der
Moleküle zu, die schnellere Bewegung wirkt gegen die intermolekularen
Anziehungskräfte und bewirkt einen erhöhten Platzbedarf für jedes einzelne Molekül
⇒ Volumen-vergrößerung.
Wenn zwei Flüssigkeiten miteinander mischbar sind, diffundieren ihre Moleküle und vermischen sich ebenfalls vollständig. Die Diffusion verläuft bei Flüssigkeiten erheblich langsamer als bei Gasen. Da die Moleküle bei Flüssigkeiten eng beieinander sind, erfährt ein Molekül eine enorme Zahl von Stößen pro Zeiteinheit. Die freie Weglänge zwischen zwei Stößen ist bei einer Flüssigkeit wesentlich geringer als bei einem Gas ⇒ die Moleküle brauchen mehr Zeit um sich zu vermischen.
Viskosität ("Zähigkeit") ist die Eigenschaft von Flüssigkeiten, dem Fließen einen Widerstand entgegenzusetzen (z.B.: Honig ist viskoser als Wasser). Der Widerstand ist hauptsächlich auf die intermolekularen Kräfte zurückzuführen und ist somit ein direktes Maß für diese Kräfte. Sie sind im allgemeinen um so weniger wirksam, je schneller die Moleküle sich bewegen, weshalb die Viskosität bei Temperaturerhöhung abnimmt und bei Druckerhöhung zunimmt (s.o.).
Oberflächenspannung ist eine weiter Eigenschaft, die direkt durch intermolekulare
Kräfte bewirkt wird. Ein Molekül im Inneren einer Flüssigkeit erfährt von allen Seiten
eine gleichmäßige Anziehungskraft. Moleküle an der Flüssigkeitsoberfläche erfahren
nur eine einseitige Anziehung in das Innere der Flüssigkeit.
Daher hat eine Flüssigkeit die Tendenz, ihre Oberfläche so klein wie möglich zu
halten und ein Flüssigkeitstropfen erhält so seine kugelförmige Gestalt. Die
Moleküle an der Oberfläche des Tropfen, werden alle gleich stark in das Zentrum
gezogen.
Die Oberflächenspannung nimmt bei steigender Temperatur ab, da die schnellere
Molekülbewegung den intermolekularen Kräften entgegenwirkt.
Der Verlust der energiereichen Moleküle ("schnelle Moleküle") hat eine Abnahme der Energie der verbleibenden Flüssigkeit zur Folge ⇒ die Temperatur der Flüssigkeit geht zurück. Durch Wärmezufuhr aus der Umgebung kann die Temperatur der Flüssigkeit, und somit die kinetische Energie der Moleküle aufrechterhalten werden. Der Prozeß setzt sich fort bis die gesamte Flüssigkeit verdampft ist. (merke: Abkühlung der Körpertemperatur durch Schwitzen)
Die Zahl der Moleküle, die pro Zeiteinheit aus der Gasphase in die Flüssigkeit
zurückkehren, hängt von ihrer Konzentration in der Gasphase ab. Je mehr Moleküle
im Dampf (Gasphase) vorhanden sind, desto mehr Moleküle treffen die Oberfläche
der Flüssigkeit und werden von ihr aufgenommen.
Zu Beginn des Verdampfungsprozesses sind noch wenige Moleküle in der
Gasphase und nur wenige finden in die Flüssigkeit zurück. Mit fortschreitender
Verdampfung (Wasser --> Dampf) nimmt ihre Zahl in der Gasphase zu und die
Menge der kondensierenden (Dampf --> Wasser) ebenfalls. Nach einiger Zeit wird
ein Zustand erreicht, bei dem die Verdampfungs- und
Kondensierungsgeschwindigkeit gleich groß sind.
Dieser Zustand, in dem zwei gegenläufige Vorgänge gleich schnell ablaufen, wird Gleichgewichtszustand genannt.
Im Gleichgewichtszustand bleibt die Konzentration der Moleküle im Dampf konstant,
weil pro Zeiteinheit gleich viel Moleküle pro Zeiteinheit den Dampf durch
Kondensation verlassen wie durch Verdampfung neu hinzukommen. Genauso bleibt
auch die Flüssigkeitsmenge unverändert. Dies bedeutet aber nicht, daß im
Gleichgewichtszustand nichts mehr vor sich geht. Verdampfung und Kondensation
gehen nach wie vor weiter; sie sind nicht zum Stillstand gekommen, sondern laufen
gleich schnell ab.
Der Druck des Dampfes, der bei gegebener Temperatur mit der Flüssigkeit im
Gleichgewicht steht, wird Dampfdruck genannt. Dieser ist Temperatur abhängig.
Beim Erwärmen einer kristallinen Substanz schmilzt sie bei der gleichen Temperatur, bei der die Flüssigkeit gefriert. Diese Temperatur wird Schmelzpunkt genannt.
Ionenkristalle: Positiv und negativ geladene Ionen werden durch elektrostatische Anziehung zusammengehalten. Es handelt sich um starke Kräfte, und deshalb haben Ionenkristalle hohe Schmelzpunkte. Sie sind hart und spröde. Ionenverbindungen sind gute elektrische Leiter, wenn sie geschmolzen oder gelöst sind, nicht aber im kristallinen Zustand, bei dem die Ionen fest auf ihren Plätzen verankert sind. Beispiele hierfür sind zum Beispiel Kochsalz oder KNO3.
Molekülkristalle: Moleküle werden nur durch Londonsche Kräfte und eventuell noch durch Dipol-Kräfte zusammengehalten. Diese sind um einiges schwächer als die elektrostatischen. Dementsprechend sind Molekülkristalle weich und haben relativ niedrige Schmelzpunkte. Sie leiten im allgemeinen nicht den elektrischen Strom.
Gerüststrukturen: Atome werden durch ein Netzwerk von kovalenten Bindungen zusammengehalten. Bei einer dreidimensional verknüpften Struktur kann der ganze Kristall als ein Riesenmolekül angesehen werden. Diese Substanzen haben hohe Schmelzpunkte und sind sehr hart. Schlechte Leiter. (Bsp.: Diamant) Strukturen die nur zweidimensional verknüpft sind bilden eine Schichtstruktur. Bsp.: Glimmer. Eindimensionale Verknüpfung nennt man Kettenstruktur.
Metallische Kristalle: Metallatome haben ihre Valenzelektronen an eine allen
Atomen gemeinsam angehörende Elektronenwolke abgegeben. Der Rest der Atome,
d.h. positiv geladene Ionen, nehmen feste Plätze im Kristall ein. Die Elektronen in
der Wolke können sich frei durch den ganzen Kristall bewegen, weshalb man auch
von einem Elektronengas spricht. Das Elektronengas hält die Metallionen
zusammen.
Die metallische Bindung ist eine starke Bindung. Viele Metalle haben hohe
Schmelzpunkte, hohe Dichte und Strukturen, in denen Metallionen dicht
zusammengepackt sind. Sie sind gut deformierbar, hierbei werden die Metallionen
gegenseitig verschoben; wegen des gleichmäßig verteilten Elektronengases bleibt
die Bindung trotzdem erhalten. Metalle sind gute elektrische Leiter.
| Strukturtyp | Teilchen | Bindungskräfte | Eigenschaften | Beispiele |
|---|---|---|---|---|
| Ionenkristall | Ionen | elektrostatische Anziehungskraft | hoher Smp. hart, spröde elek.Isolator | NaCl, BaO, KNO3 |
| Molekülkristall | Moleküle | London, Dipol | niedriger Smp. weich elek.Isolator | H2O, NH3 SO2, H2, Cl2, CH4 |
| Gerüststruktur | Atome | kovalente Bindungen | hoher Smp. sehr hart elek.Isolator | Diamant SiO2 |
| Schichtenstruk. | Atome + Ionen | kovalente Bindung | hoher Smp. weich elek.Isolator | Graphit Glimmer Ton |
| Kettenstruktur | Atome + Ionen | kovalente Bindung | faserig | Selen Isolatoren |
| Metallkristall | positive Ionen u. bewegliche Elektronen | metallische Bindung | oft hoher Smp. verformbar elek. leitend | Cu, Ag Fe, Na |