Gase
Gase bestehen aus räumlich weit voneinander getrennten Molekülen oder Atomen in
schneller Bewegung. Zwei (oder mehrere) beliebige Gase können in jedem
Verhältnis völlig homogen vermischt werden (Diffusion) .Ähnliches gilt nicht
generell auch für Flüssigkeiten. Da zwischen den Molekülen eines Gases relativ
große Zwischenräume bestehen , können die Moleküle eines zweiten Gases leicht
dazwischen geschoben werden. Dasselbe passiert bei der Kompression eines
Gases, nur werden hier die Moleküle durch Druck enger zusammen gebracht.
Ein Gas füllt ein Gefäß immer vollständig aus.
Druck ist definiert als Kraft pro Fläche. In der Chemie ist der Atmosphärendruck eine
wichtige Bezugsgröße.
Barometer
Der Atmosphärendruck wird mit Hilfe eines Barometers gemessen. Das älteste
Modell, aus dem 17. Jhr., besteht aus einem am Ende verschlossenen Rohr von
etwa 85 cm Länge. Dieses wurde mit Quecksilber gefüllt und in ein offenes, mit
Quecksilber gefülltes Gefäß gestellt. Das Quecksilber im Rohr sinkt auf ein
bestimmtes Maß weit ab. Der Atmospärendruck, der außen auf der
Quecksilberoberfläche lastet, hält eine Säule bestimmter Höhe im Rohr fest. Der
Zwischenraum zwischen dem Quecksilber und dem Rohrende ist ein fast perfektes
Vakuum. Da Quecksilber bei Raumtemperatur nur sehr wenig flüchtig ist, befindet
sich nur eine vernachlässigbare Menge Quecksilberdampf im Zwischenraum. Der
Druck innerhalb des Rohres auf der Höhe des Bezugsniveaus stammt allein vom
Gewicht der Quecksilbersäule; dieser Druck ist gleich dem außen herrschenden
Atmosphärendruck.
Die Höhe der Quecksilbersäule ist ein direktes Maß für den Atmosphärendruck. Der
Athmosphärendruck ist von der Höhenlage des Standorts und, in geringem Maße
vom Wetter abhängig. Der mittlere Druck auf Höhe des Meeresspiegels bei 0°C hält
eine Quecksilbersäule von 760 mm Höhe. Dieser Druck wird Normaldruck genannt.
Schon 1808 konnten chemische Versuche nachweisen, das die Volumina von
Gasen, die bei Reaktionen verbraucht werden oder entstehen, in einem
ganzzahligen Verhältnis zueinander stehen, sofern alle Volumina bei gleichem
Druck und gleicher Temperatur gemessen werden.
Eine der untersuchten Reaktionen war die von Wasserstoffgas mit Chlorgas, bei der
Chlorwasserstoffgas („gasförmige Salzsäure") entsteht:
1 Volumen Wasserstoff + 1 Volumen Chlor --> 2 Volumen Chlorwasserstoff
Damals kannte man noch keine chemischen Formeln, heute würde man formulieren:
1 H2 (g) + 1 Cl2 (g) --> 2 HCl (g)
Die Erklärung für diese Volumenverhälnisse wurde 1811 von Amedeo Avogadro
gegeben. Nach dem Avogadroschen Gesetz enthalten gleiche Volumina
beliebiger Gase bei gleicher Temperatur und gleichem Druck die gleiche
Anzahl von Molekülen.
Diese genaue Beziehung der Volumeneinheiten untereinander gilt nur für Gase.
Wenn gleiche Volumina zweier Gase bei gleicher Temperatur und gleichem Druck
gleich viele Moleküle enthalten, dann gilt umgekehrt auch:
Eine gleich große Zahl von Molekülen zweier Gase beansprucht bei gleichem Druck
und gleicher Temperatur das gleiche Volumen. Dies gilt unabhängig von der Art der
Moleküle, weil sie räumlich so weit von einander getrennt sind das ihre Form und
oder Größe vernachläßigbar ist.
Ein Mol eines Gases besteht aus 6,022*1023 Teilchen (Avogadrosche Zahl). Ein Mol
eines Gases nimmt unter gleichen Druck-Temperatur-Bedingungen das gleiche
Volumen wie ein beliebiges anderes Gas ein.
Unter Normalbedingungen (0°C und 1 atm) nimmt ein Mol eines Gases ein Volumen
von 22,414 Litern ein.
Druck, Volumen und Temperatur sind Zustandsgrößen. Für Gase gibt es eine enge
Beziehung zwischen diesen Größen und der Stoffmenge:
p * V = n * R * T
Dabei ist p der Druck, V das Volumen, n die Stoffmenge und T die Temperatur in
Kelvin und R ist die ideale Gaskonstante.
Die meisten Gase erfüllen unter gewöhnlichen Bedingungen recht gut die Gleichung.
Ein hypothetisches Gas, das unter allen Bedingungen die Gleichung exakt erfüllt,
nennt man ideales Gas. Die Gleichung wird deshalb ideales Gasgesetz genannt.
Die Gleichung beschreibt einen einfachen Kurvenverlauf:
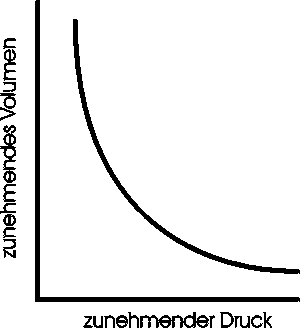 Wenn ein Gas bei konstantem Druck erwärmt wird, dehnt es sich aus. Eine
Temperaturerhöhung um 1°C bewirkt eine Ausdehnung um 1/273 des Volumens,
das bei 0°C eingenommen wird.
Wenn ein Gas bei konstantem Druck erwärmt wird, dehnt es sich aus. Eine
Temperaturerhöhung um 1°C bewirkt eine Ausdehnung um 1/273 des Volumens,
das bei 0°C eingenommen wird.
Völlig gleichartig ist auch die Abhängigkeit des Drucks, wenn die Temperatur erhöht
wird. Für jedes °C Temperaturerhöhung steigt der Druck um 1/273 des Druckes, der
bei 0°C herrscht.
(Diese Beobachtungen nennt man die Gay-Lussacschen Gesetze)
Mit Hilfe der kinetischen Gastheorie können die bei Gasen herrschenden
Gesetzmäßigkeiten erklärt werden. Sie basiert auf folgenden Postulaten:
1.) Gase bestehen aus Teilchen (Molekülen oder Atomen), die im Raum weit verteilt
sind. Das Volumen der einzelnen Teilchen ist vernachlässigbar klein im Vergleich
zum Gesamtvolumen.
2.) Die Teilchen im Gas befinden sich in ständiger, schneller und geradliniger
Bewegung. Sie stoßen miteinander und mit der Gefäßwand zusammen. Bei den
Stößen kann Energie von einem Teilchen auf ein anderes übertragen werden, aber
insgesamt geht keine kinetische Energie verloren.
3) Die mittlere kinetische Energie („Geschwindigkeit der Teilchen") hängt von der
Temperatur ab; sie nimmt mit der Temperatur zu. Bei gegebener Temperatur ist die
mittlere kinetische Energie für alle Gase die gleiche.
4.) Anziehungskräfte zwischen den Teilchen sind vernachlässigbar.
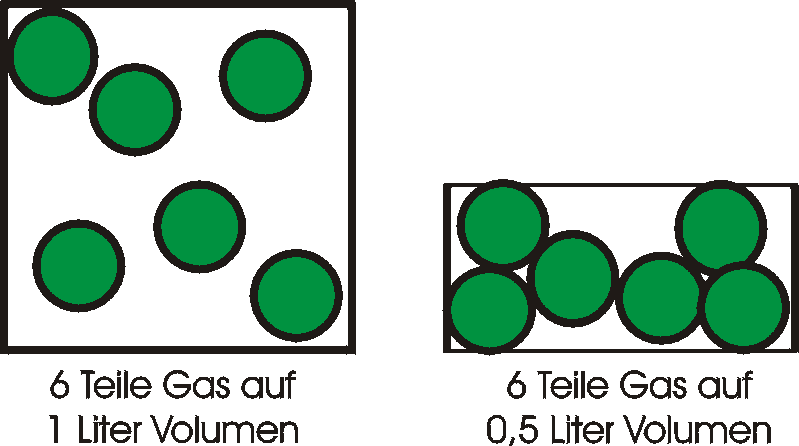
Die Gasgesetze können mit der kinetischen Theorie erklärt werden. Nach der
Theorie kommt der Druck durch die ständigen Kollisionen der Teilchen mit der
Gefäßwand zustande. Wenn die Zahl der Teilchen pro Volumeneinheit vergrößert
wird, verursacht die vergrößerte Zahl von Kollisionen einen erhöhten Druck. Eine
Verkleinerung des Volumens vermehrt die Zahl der Teilchen pro Volumeneinheit.
Verkleinerung des Volumens bewirkt also eine Druckerhöhung.
 Mit zunehmender Temperatur nimmt die mittlere kinetische Energie und damit die
mittlere Geschwindigkeit der Teilchen zu. Die Stöße gegen die Gefäßwände werden
heftiger und häufiger. Als Konsequenz steigt der Druck mit der Temperatur.
Mit zunehmender Temperatur nimmt die mittlere kinetische Energie und damit die
mittlere Geschwindigkeit der Teilchen zu. Die Stöße gegen die Gefäßwände werden
heftiger und häufiger. Als Konsequenz steigt der Druck mit der Temperatur.
Das ideale Gasgesetz erfaßt das Verhalten eines idealen Gases („das gibt es gar
nicht") - ein Gas, das die Voraussetzungen der kinetischen Gastheorie erfüllt. Unter
gewöhnlichen Druck- und Temperatur-Verhältnissen erfüllen reale Gase das ideale
Gasgesetz recht gut, bei niedrigen Temperaturen und/oder hohen Drücken, jedoch
nicht. Die Kurven realer Gase weichen von der Kurve eines idealen Gases, in den
Grenzbereichen, deutlich ab.
Hierfür gibt es zwei Gründe:
Intermolekulare Anziehungskräfte:
Eine der Voraussetzungen der kinetischen Gastheorie ist das Fehlen von
Anziehungskräften zwischen den Molekülen. Solche Anziehungskräfte müssen
jedoch existieren, anderenfalls wäre es nicht möglich, Gase zu verflüssigen, denn
intermolekulare Anziehungskräfte halten die Moleküle einer Flüssigkeit zusammen.
Je höher der Druck ist, desto mehr rücken die Moleküle aneinander und desto
stärker macht sich die intermolekulare Anziehungskraft bemerkbar.
Molekularvolumen:
Die kinetische Gastheorie geht von punktförmigen Molekülen aus, die keinen
eigenen Raumbedarf haben. Dementsprechend ist nach dem idealen Gasgesetz das
Volumen gleich Null, wenn beim absoluten Temperatur-Nullpunkt die molekulare
Bewegung zum Stillstand gekommen ist. Die Moleküle realer Gase haben aber ein
eigenes Volumen. Bei Druckerhöhung werden die Abstände zwischen den
Molekülen verringert, aber die Moleküle selbst können nicht „zusammengequetscht"
werden.
Wegen der intermolekularen Anziehungskräfte verhalten sich Moleküle so ähnlich,
als hätten sie eine klebrige Oberfläche. Wegen der hohen Geschwindigkeit der
Moleküle und wegen der großen Zahl von Stößen können die Moleküle in einem
Gas nicht aneinander haften bleiben.
Bei Absenkung der Temperatur nehmen die Molekülgeschwindigkeiten ab und die
Stöße werden weniger heftig --> die Moleküle können aneinander haften bleiben.
Ähnlich wirkt eine Erhöhung des Drucks; die Moleküle sind weniger weit von
einander entfernt und die Anziehungskräfte werden deshalb wirksamer. Bei
Druckerhöhung und/oder Temperaturerniedrigung weicht das Gas immer mehr vom
idealen Verhalten ab und wird schließlich flüssig.
home /
Chemie-Ecke


