| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
Betrachten wir wieder unsere Reaktionsgleichung:
Während die Reaktion abläuft, werden A2 und X2 verbraucht, ihre Konzentrationen
nehmen kontinuierlich ab. Gleichzeitig entsteht AX, dessen Konzentration laufend
zunimmt.
Reaktionsgeschwindigkeiten hängen im allgemeinen von den Konzentrationen der reagierenden Substanzen ab. Ist die Konzentration hoch, ist meistens auch die Reaktionsgeschwindigkeit hoch. Dies läßt sich mit der Kollisionstheorie erklären. Bei hohen Konzentrationen sind zahlreiche Moleküle in einem gegebenen Volumen vorhanden. Es kommt zu häufigen Kollisionen, bei denen die reagierenden Moleküle in die Reaktionsprodukte verwandelt werden; die Reaktion läuft schnell ab.
Betrachten wir wieder unsere Reaktion:
Wenn ein A2-Molekül mit einem X2-Molekül kollidiert, wird die A-A-Bindung und die X-X-Bindung aufgebrochen und gleichzeitig werden zwei neue A-X-Bindungen geknüpft. Die Reaktionsgeschwindigkeit ist abhängig von der Anzahl der Kollisionen pro Zeiteinheit.
Die Zahl der Kollisionen in einem Gas ist enorm groß. Bei Raumtemperatur erfolgen in einem Liter Gas etwa 1031 Kollisionen pro Sekunde. Wenn jede Kollision zu einer Reaktion führen würde, wäre die Gesamtreaktion in weniger als einer Sekunde beendet. Die meisten Reaktionen verlaufen wesentlich langsamer. Im allgemeinen führt nur ein kleiner Bruchteil der stattfindenden Kollisionen tatsächlich zu Reaktionen; diese heißen effektive Kollisionen.
Wenn eine Kollision nicht effektiv ist, so kann das zwei Gründe haben. Zum einen können die Moleküle eine ungünstige Lage zueinander haben. Zum anderen sind viele Kollisionen nicht heftig genug, um einen Bruch der Bindung zu bewirken; die Moleküle prallen unverändert von einander ab. Für eine effektive Kollision muß die Geschwindigkeit der Moleküle einen Mindestwert übersteigen
Temperaturabhängigkeit: Bei allen chemischen Reaktionen nimmt die Reaktionsgeschwindigkeit mit steigender Temperatur zu. Dies gilt für exotherme wie für endotherme Reaktionen. Eine Temperaturerhöhung um 10°C bewirkt häufig eine Geschwindigkeitssteigerung auf das zwei- bis vierfache (RGT-Regel). Die schnellere Bewegung bei höheren Temperaturen bringt eine größere Zahl von effektiven Kollisionen mit sich.
RGT-Regel: Definition aus dem Schülerduden
RGT (Reaktionsgeschwindigkeit-Temperatur) -Regel, eine von van't Hoff aufgestellte (durch
Ausprobieren gefundene) Regel, die besagt, daß eine Temperaturerhöhung um 10°C eine
Steigerung der Reaktionsgeschwindigkeit um das 2-4fache zur Folge hat. Mittlerweile zeigt
diese Regel bereits mehrere Ausnahmen. Es sind sogar kompliziert verlaufende Reaktionen
bekannt, bei denen die Reaktionsgeschwindigkeit mit zunehmender Temperatur abnimmt.
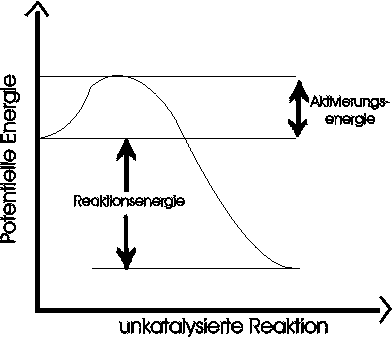
Betrachten wir eine unkatalysierte Reaktion:

Die katalysierte Reaktion verläuft über zwei Stufen:
Zuerst geht A eine Verbindung mit dem Katalysator (Kat) ein, und es entsteht AKat, dann erst reagiert X mit AKat und es entsteht AX und der Katalysator ist wieder frei. Dieser kann erneut mit A reagieren --> deshalb reichen kleine Mengen an Katalysator aus um Reaktionen ablaufen zu lassen.
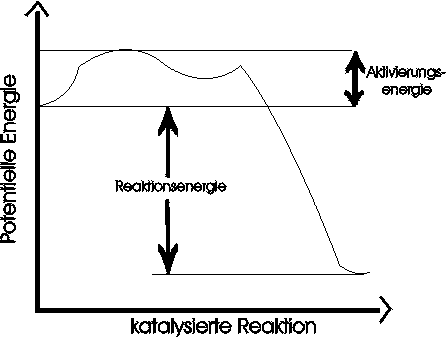
Der Katalysator eröffnet einen neuen Weg für den Ablauf der Reaktion, bei dem insgesamt die Aktivierungsenergie niedriger ist als ohne die Anwesenheit des Katalysators (die Moleküle müssen nicht mehr so schnell sein um zu reagieren). Die niedrigere Aktivierungsenergie bedingt die höhere Reaktionsgeschwindigkeit.
1.) Die Reaktionsenergie DeltaU wird durch den Katalysator nicht geändert.
2.) Bei einer reversiblen Reaktion wird auch die Rückreaktion gleichermaßen katalysiert.
Bei der homogenen Katalyse ist der Katalysator in der gleichen Phase anwesend wie die Reaktanden.
Bei der heterogenen Katalyse liegen Katalysator und Reaktanden in
unterschiedlichen Phasen vor. Der Katalysator ist in der Regel fest und die reagierenden
Moleküle werden an seiner Oberfläche adsorbiert.
Unter Adsorption versteht man das Haftenbleiben von Molekülen an der Oberfläche
eines Feststoffes. Durch die Adsorption werden die Moleküle an der Oberfäche
chemisch gebunden, dadurch wird die Verteilung der Elektronen am adsorbierten
Molekül verändert; manche Molekülbindungen können geschwächt oder sogar
aufgebrochen werden und sind somit frei für neue Bindungen.
Katalysatorgifte sind Substanzen, die die Wirksamkeit eines Katalysators
unterbinden. Der Autokatalysator kann schnell durch Blei vergiftet werden.
Deswegen muß ein Auto mit geregeltem Katalysator bleifreies Benzin tanken.
Zur Reinigung der Autoabgase dient ein Katalysator aus einer Platin-Rhodium-
Legierung. Durch unvollständige Verbrennung des Benzins enthalten die Abgase
Kohlenmonoxid; außerdem sind Stickoxide vorhanden, die bei den hohen
Temperaturen zum Zeitpunkt der Verbrennung aus Luftstickstoff und Sauerstoff
entstehen.
Der Katalysator fördert die Reaktion zwischen Stickstoffmonoxid und Kohlenmonoxid
zu Kohlendioxid und Stickstoff.
Zahlreiche industrielle Prozesse beruhen auf Reaktionen, die durch Katalysatoren
ermöglicht werden.
Von besonderer Bedeutung für alle Lebewesen sind biochemische Katalysatoren
(Bio-Katalysatoren), die Enzyme. Diese Eiweißstoffe katalysieren Prozesse wie die
Photosynthese, Glykolyse, DNA-Replikation, etc..