Reduktions-Oxidations-Reaktionen:
Zum besseren Verständnis dieses wichtigen Reaktionstypen in wäßriger Lösung, sollte das Konzept der Oxidationszahlen bekannt sein.Oxidationszahlen sind (fiktive) Ladungen, die den Atomen einer Verbindung nach bestimmten Regeln zugewiesen werden.
1.) Ein einzelnes Atom oder ein Atom in einem Element hat die Oxidationszahl 0.
2.) Die Oxidationszahl eines einatomigen Ions ist identisch mit seiner Ionenladung.
3.) Die Summe der Oxidationszahlen aller Atome eines mehratomigen Ions ist gleich der Ladung dieses Ions.
4.) Die Summe der Oxidationszahlen aller Atome eines Moleküls ist Null.
5.) Fluor hat in allen Verbindungen die Oxidationszahl -I .
6.) Sauerstoff hat, bis auf wenige Ausnahmen, die Oxidationszahl -II .
7.) Wasserstoff hat in Verbindungen mit Nichtmetallen die Oxidationszahl +I . In Metallhydriden (LiH, MgH2) hat Wasserstoff die Oxidationszahl -I .
Einem Element können in verschiedenen Verbindungen unterschiedliche
Oxidationszahlen zukommen. Zum Beispiel reicht die Skala der Oxidationszahlen
beim Stickstoff von -III (z.B. im NH3) bis +V (z.B. in HNO3).
Die höchstmögliche Oxidationszahl eines Elements ist gleich seiner
Gruppennummer im Periodensystem. (auch hier gibt es einige Ausnahmen)
Der Begriff Oxidation wurde ursprünglich für Reaktionen verwendet, bei denen sich Sauerstoff mit anderen Substanzen verbindet, und unter Reduktion verstand man die Entfernung von gebundenem Sauerstoff aus einer Verbindung. Die heutige Definition ist allgemeiner und bezieht sich auf die Oxidationszahlen.
Ein Elektron , das einem Atom entzogen wird, muß nicht völlig von ihm entfernt werden; es genügt, wenn eine polare kovalente Bindung mit einem elektronegativeren Atom geknüpft und die Bindungselektronen dadurch nur teilweise abgezogen werden. Entsprechend liegt eine Reduktion bereits vor, wenn eine kovalente Bindung mit einem weniger elektronegativen Atom eingegangen wird. --> Eine Oxidation ist ein Prozeß, bei dem die Oxidationszahl eines Atoms erhöht wird, bei einer Reduktion wird die Oxidationszahl erniedrigt.
Bei der Reaktion von Schwefel mit Sauerstoff entsteht SO2; dabei nimmt die Oxidationszahl des Schwefelatoms von Null nach +IV zu, der Schwefel wird oxidiert; die Oxidationszahl der Sauerstoffatome erniedrigt sich von Null auf -II, Sauerstoff wird reduziert.
![]()
Weder eine Oxidation noch eine Reduktion können für sich alleine auftreten. Elektronen, die von einem Atom abgezogen werden, werden anderen Atomen zugeführt. Wegen dieser stets vorhandenen Kopplung von Oxidation und Reduktion sprechen wir von Redox-Reaktion. Die dazugehörigen Gleichungen werden Redox- Gleichungen genannt.
Die Substanz, die dem Reaktionspartner die Elektronen entzieht und damit dessen Oxidation bewirkt, nennen wir das Oxidationsmittel; es wird selbst reduziert. Umgekehrt wirkt eine Substanz, die selbst oxidiert wird, als Reduktionsmittel. Im obigen Beispiel ist Schwefel das Reduktionsmittel und Sauerstoff das Oxidationsmittel.
Reaktionsgleichungen, bei denen Redox-Prozesse ablaufen, sind meist schwieriger
zu formulieren als andere Gleichungen.
Bei Redox-Gleichungen kommt es darauf an, die Zahl der vom Reduktionsmittel
abgegebenen und die Zahl der vom Oxidationsmittel aufgenommenen Elektronen
auszugleichen (--> Oxidationszahlzunahme = Oxidationszahlabnahme). Zusätzlich
müssen die anderen Regeln zur Aufstellung von Reaktionsgleichungen beachtet
werden.
Man geht in vier Schritten vor:
1.) Edukte und Produkte, die an der Reduktion und Oxidation beteiligt sind, sind als erstes alle anzugeben; für sie werden die entsprechenden Oxidationszahlen ermittelt.
2.) Das Zahlenverhältnis, in dem Reduktionsmittel und Oxidationsmittel miteinander reagieren, wird bestimmt, indem die Oxidationszahlenzunahme und Oxidationszahlenabnahme ausgeglichen wird.
3.) Die Summe der Ionenladungen und die Anzahl anderer Atome auf beiden Seiten der Gleichung wird ausgeglichen. Um die Ionenladungen in wäßriger Lösung auszugleichen, dienen H+- und OH--Ionen.
4.) Man ermittelt, um wieviel Einheiten die Oxidationszahl des Reduktionsmittels zunimmt (Elektronenabgabe!!) und schreibt die entsprechende Zahl vor die Formel des Oxidationsmittels; dann bestimmt man um wieviel Einheiten die Oxidationszahl des Oxidationsmittels erniedrigt wird (Elektronenaufnahme!!) und schreibt die entsprechende Zahl vor die Formel des Reduktionsmittels.
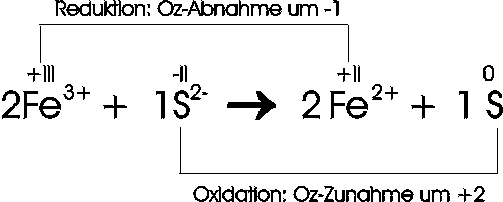
In diesem einfachen Beispiel ist Fe3+ das Oxidationsmittel, es selbst wird zu Fe2+ reduziert. Dieses hat eine Abnahme seiner Oxidationszahl um eine Einheit (-1) zu Folge. Deswegen können wir vor die Formel des Reduktionsmittels (hier: S2-) eine 1 schreiben. Das Reduktionsmittel selbst wird oxidiert; seine Oxidationszahl nimmt um zwei Einheiten (+2) zu. Aus diesem Grund schreiben wir vor Eisen (Fe), dem Oxidationsmittel, eine 2. Dadurch ist die Gleichung ausgeglichen.
Disproportionierung: Dieses ist eine Redox-Reaktion, bei der ein Element
gleichzeitig oxidiert und reduziert wird und aus einer Verbindung zwei Produkte
entstehen.
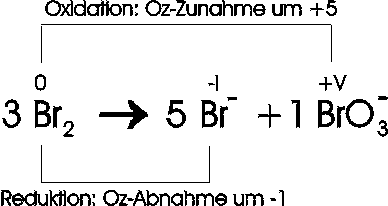
Zum Beispiel disproportioniert Brom in basischer Lösung zu Bromid und Bromat:
Die Aufstellung der Gleichung erfolgt nach dem gleichen Verfahren wie oben.
Hier mehr über Oxidationszahlen.
Arrhenius-Säuren und -Basen
Das älteste Konzept für die Definition von Säure und Base geht auf Arrhenius zurück.Eine Säure ist eine Substanz, die unter Bildung von H3O+-Ionen dissoziiert, wenn sie in Wasser gelöst wird. z.B.:
Reines HCl-Gas besteht aus Molekülen. In Wasser gelöst, wird das H+-Ion, das
nichts anderes als ein Proton ist, stärker von einem freien Elektronenpaar am
Sauerstoffatom eines Wassermoleküls angezogen als von seinem ursprünglichen
Partner, dem Chloratom.
Das Proton wird vom H-Cl Molekül abgespalten und auf das Wassermolekül
übertragen. Es entsteht ein Oxonium-Ion (auch Hydronium-Ion), H3O+, und ein
Cl--Ion.
Jedes Ion in wäßriger Lösung hydratisiert, d.h. es ist von Wassermolekülen
umgeben, die von dem Ion elektrostatisch angezogen werden.
Die Zahl der Wassermoleküle die ein Ion umgeben, ist häufig unbekannt und
veränderlich. Das H+-Ion ist jedoch ein besonderer Fall. Die Ladung des H+-Ions als
reines Proton wird durch keine Elektronen abgeschirmt und verglichen mit anderen
Ionen ist das H+-Ion extrem klein. Es wird deshalb stark von einem freien
Elektronenpaar des H2O-Moleküls angezogen. Das H3O+-Molekül selbst wird durch
weitere H2O-Moleküle hydratisiert, die über Wasserstoffbrücken daran gebunden
sind. Wegen dieser Verhältnisse wird das hydratisierte Proton vielfach mit H+
bezeichnet:
Diese Art Reaktion ist eine Säure-Dissoziation.
Nach Arrhenius ist eine Base eine Substanz, die Hydroxid-Ionen, OH-, enthält oder beim Lösen in Wasser hydratisierte OH--Ionen bildet:
Nur die Hydroxide der Elemente der ersten Hauptgruppe sowie Ca(OH)2, Sr(OH)2, Ba(OH)2 und TiOH sind wasserlöslich. Aber auch schwerlöslich Hydroxide reagieren mit Säuren in der gleichen Art wie Basen.
Die Reaktion zwischen einer Säure und einer Base heißt Neutralisation:
Bei der Neutralisation einer Lösung von Ba(OH)2 und einer HCl-Lösung entsteht
eine Lösung von Bariumchlorid, BaCl2; im zweiten Beispiel entsteht eine Lösung von
Eisen(III)-Nitrat, Fe(NO3)3.
Diese Reaktionsprodukte heißen Salze, ihr Kation stammt von der Base, ihr Anion
von der Säure.
Die Ionengleichung für eine Neutralisationsreaktion ist:
Säuren werden als stark oder schwach klassifiziert ganz nachdem wie weit sie in
wäßriger Lösung dissoziieren.
Starke Säuren sind in (verdünnter) wäßriger Lösung zu 100% dissoziiert.
(Bsp.: HCl, HBr, HI, HNO3, H2SO4, HClO3, HClO4)
Schwache Säuren sind in verdünnter wäßriger Lösung nur zu einem kleinen Bruchteil dissoziiert. Essigsäure ist z.B. eine schwache Säure:
Der Doppelpfeil (<-->) soll zeigen, daß die Reaktion in beide Richtungen ablaufen kann.
Eine wichtige schwache Base ist die wäßrige Lösung von Ammoniak, NH3:
Bei dieser Reaktion übernimmt das Ammoniakmolekül ein Proton vom Wassermolekül unter Bildung des Ammonium- und des Hydroxidions.
Säuren die nur ein Proton pro Molekül abgeben können, nennen wir einprotonig. Mehrprotonige Säuren können mehr als ein Proton pro Molekül abgeben. Schwefelsäure, H2SO4, gehört dazu, genauso wie H3PO4 (Phosphorsäure).
Amphotere Verbindungen haben sowohl sauren als auch basischen Charakter. Sie reagieren mit starken Säuren sowie mit starken Basen. Aluminiumhydroxid, Al(OH)3, ist ein Beispiel.
Volumetrische Analyse
Eine volumetrische Analyse dient zur Mengenbestimmung einer Substanz. Dabei kommt es auf die genaue Messung des Volumens einer Lösung an. Zu diesem Zweck wird eine Titration durchgeführt. Hierbei wird eine Lösung unbekannter Konzentration mit einer Lösung bekannter Konzentration langsam vermischt, bis eine Reaktion zwischen den beiden Lösungen vollständig abgelaufen ist. Einfachstes Beispiel ist die Titration einer Base unbekannter Konzentration mit einer Säure bekannter Konzentration (oder auch umgekehrt). Hierbei wird der Base vorher ein Indikator zugefügt, der den pH-Wert durch Farbumschlag anzeigt. Die Säure wird solange zugefügt, bis der Indikator den pH-Wert von Wasser (pH: 7, Neutralpunkt) anzeigt.Die Lösung mit der bekannten Konzentration befindet sich in einer Bürette. Das ist ein Rohr mit geeichter Graduierung. Am unteren Ende befindet sich ein Hahn, der es erlaubt, die Lösung in kontrollierter Menge ausfließen zu lassen. Der genaue Endpunkt der Reaktion wird auch Äquivalenzpunkt genannt.
Äquivalentmasse und Normallösung
Wie beschrieben kommt es bei den Lösungen in der Bürette darauf an, die Konzentration der reagierenden Teilchen zu kennen. Die Stoffmengenkonzentration des gelösten Stoffes entspricht nicht immer der Stoffmengenkonzentration der Teilchen, auf die es bei der Reaktion ankommt.So enthalten mehrprotonige Säuren wie zum Beispiel H2SO4 mehr als ein reagierendes Teilchen pro Molekül; so kann H2SO4 zwei H+-Ionen pro Molekül abgeben (Man sagt auch H2SO4 ist zweiwertig). D.h., daß man mit 1 mol H2SO4 2 mol NaOH neutralisieren kann.
Teilt man die Molmasse (Atomgewicht, Molekulargewicht) von H2SO4 durch 2, so
erhält man seine Äquivalentmasse (Äquivalentgewicht).
Dies entspricht der Masse, die genau 1 mol NaOH neutralisiert.
Die Äquivalentzahl z ist die Zahl der für die Reaktion maßgeblichen Teilchen pro Molekül. Sie beschreibt in etwa den veralteten Begriff Wertigkeit.
Definition Schülerduden Chemie:
Wertigkeit, ein Hilfsbegriff für die Aufstellung, Deutung und Ordnung chemischer
Formeln. Ursprünglich verstand man unter der Wertigkeit die Anzahl der von einem
bestimmten Atom gebundenen oder ersetzten Wasserstoffatome. (...)
Allgemein gilt:
Die Äquivalentkonzentration (früher Normalität) ist die Stoffmengenkonzentration
bezogen auf Äquivalente, d.h. die Anzahl der Mole von reagierenden Teilchen pro
Liter Lösung. Eine Normallösung ist eine Lösung, deren Konzentration als
Äquivalentkonzentration angegeben wird.
--> Eine 1 normale H2SO4-Lsg. ist 0,5 molar.