| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
Zur fünften Hauptgruppe des Periodensystems gehören die Elemente Stickstoff, Phosphor, Arsen, Antimon und Bismut. Sie unterscheiden sich stärker untereinander als die Elemente der 6. und 7. Hauptgruppe.
Den Elementen fehlen drei Elektronen, um die Edelgaskonfiguration zu erreichen. Man kann deshalb die Bildung von dreifach negativ geladenen Ionen erwarten. Stickstoff (N) bildet mit bestimmten reaktiven Metallen Ionenverbindungen, die das Nitrid-Ion, N3-, enthalten. Phosphor (P) bildet weniger bereitwillig das Phosphid-Ion, P3- . Die übrigen Elemente zeigen keine besondere Neigung, vergleichbare Ionen zu bilden, obwohl eine Vielzahl von Arseniden, Antimoniden und Bismutiden bekannt ist; diese Verbindungen haben jedoch metallische Eigenschaften oder sie sind Halbleiter mit erheblichen kovalenten Bindungsanteilen.
| Stickstoff | Phosphor | Arsen | Antimon | Bismut | |
|---|---|---|---|---|---|
| Farbe | farblos | weiß,rot,sch | grau,gelb | grau | rötlich |
| Molekülformel | N2 | P4, Pn | As4, Asn | Sbn | Bin |
| Schmelpunkt °C | -210 | 44 | 814 | 630,5 | 271 |
| Siedepunkt °C | -196 | 280 | 633 | 1325 | 1560 |
| Kovalenzradius | 74 pm | 110 | 121 | 141 | 152 |
| Ionenradius | 146 pm | 185 | n.b. | 76 | 103 |
| 1. Ionis.-Energie | 1399 | 1061 | 965 | 830 | 772 |
| Elektroneg. | 3,0 | 2,2 | 2,2 | 2,1 | 2,0 |
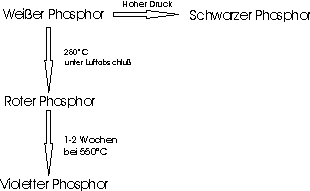
Weisser Phosphor ist ein wachsartiger Festkörper, der bei der Kondensation von Phosphor-Dampf entsteht. Er besteht aus P4-Molekülen mit einer Tetraeder-Struktur; jedes Atom hat ein nichtbindendes Elektronenpaar (freies Elektronenpaar) und kommt zu einem Elektronenoktett durch Ausbildung von je drei kovalenten Bindungen.
![]()
Weisser Phosphor ist in einigen unpolaren Lösungsmitteln löslich (z.B.: Benzol). In der Lösung liegen P4-Moleküle vor. Die gleichen P4-Moleküle treten auch im Dampf auf. Bei Temperaturen über 800°C zerfallen die Moleküle teilweise zu P2-Molekülen, die den gleichen Aufbau wie N2-Moleküle haben.
Weisser Phosphor ist die reaktionsfähigste Modifikation des Elementes. Er ist sehr giftig. In feiner verteilter Form oder bei gelindem Erwärmen entzündet er sich (Brandbomben); um eine spontane Entzündung zu verhindern, wird er unter Wasser aufbewahrt.
Roter Phsphor entsteht, wenn weisser Phosphor unter Luftausschluss auf etwa
250°C erhitzt wird. Dabei brechen Bindungen der P4-Moleküle auf und neue
Bindungen werden geknüpft, wobei ein unregelmässiges Netzwerk von Atomen
entsteht. Roter Phosphor ist somit polymer und amorph. Er ist unlöslich in allen
gängigen Lösungsmitteln, ist nicht giftig und wesentlich weniger reaktiv als weisser
Phosphor.
Wenn roter Phosphor längere Zeit (1 - 2 Wochen) auf über 550°C gehalten wird, so
ordnen sich seine Atome allmählich zu einem Kristallverband. Es entsteht der
violette Phosphor, der eine komplizierte, polymere Struktur hat. Jedes
Phosphoratom ist darin an drei andere Phosphoratome kovalent gebunden.
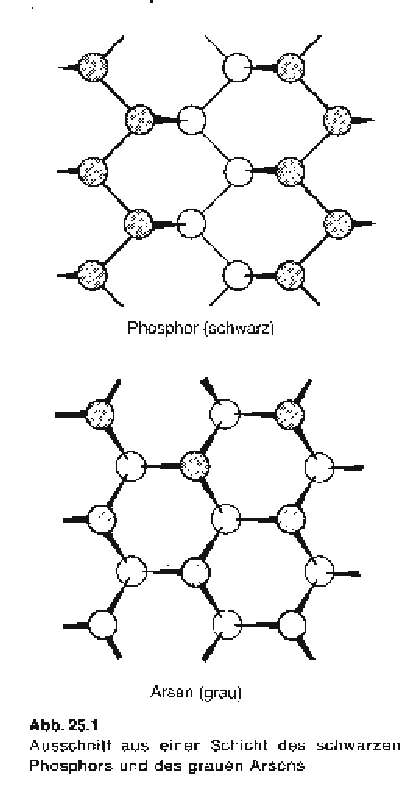
Schwarzer Phosphor ist weniger leicht zugänglich. Er entsteht aus weissem Phosphor unter hohem Druck oder wenn flüssiger Phophor in Anwesenheit von Quecksilber (Hg) als Katalysator langsam kristallisiert. Im schwarzen Phosphor sind die Atome zu gewellten Schichten verbunden, die parallel übereinander gestapelt sind.
Die Abstände zwischen benachbarten Phosphoratomen aus verschiedenen Schichten sind erheblich grösser als diejenigen zwischen Phosphoratomen innerhalb der Schicht. Innerhalb der Schicht sind die Atome durch kovalente Bindungen miteinander verbunden, während der Zusammenhalt zwischen den Schichten nur durch relativ schwache Londonsche Kräfte bewirkt wird. Dadurch bedingen sich die Eigenschaften des schwarzen Phosphors, der eine schuppige Konsistenz aufweist. Schwarzer Phosphor ist unlöslich und die am wenigsten reaktive Modifikation des Elementes.
Vom Arsen kann man durch abschrecken von Arsen-Dampf mit flüssigem Stickstoff eine gelbe Modifkation erhalten, die wie der weisse Phosphor aus As4-Molekülen besteht und in Schwefelkohlenstoff (unpolares Lsgm.) löslich ist. Es handelt sich um eine instabile Modifikation, die sich schnell in das stabile, graue Arsen umwandelt. Graues Arsen hat eine Schichtenstruktur, wobei der Aufbau der Schicht anders als im schwarzen Phosphor ist. Die gleiche Art von Schichten findet man auch in den Strukturen von Antimon und Bismut. Die kürzesten Abstände zwischen Atomen in einer Schicht und zwischen Atomen verschiedener Schichten werden vom Arsen zum Bismut immer ähnlicher; ein Bismutatom ist von sechs nächsten Atomen umgeben, drei innerhalb der Schicht, und drei aus der nächsten Schicht, die nur 15% weiter entfernt sind. Die Bindungsverhältnisse kann man als Zwischenzustand zwischen kovalenter und metallischer Bindung ansehen. Graues Arsen, Antimon und Bismut sind spröde, haben metallischen Glanz und leiten den elektrischen Strom.
Die Salpetersäure gelangt mit dem Regenwasser in das Erdreich, wo sie nach Neutralistion, zum Beispiel mit Kalk (CaCO3), in Nitrate überführt wird. Diese können von Pflanzen aufgenommen werden.
Manche Bodenbakterien, sowie die „Stickstoffbakterien", die in den Wurzelknollen
der Leguminosen leben, fixieren Luftstickstoff zu Verbindungen, die von Pflanzen
genutzt werden können.
Zur Erhöhung des verwertbaren Stickstoffs im Boden dienen Düngemittel.
Stickstoffhaltige Düngemittel werden aus Ammoniak hergestellt, der seinerseits durch
einen technischen Prozess aus Stickstoff und Wasserstoff hergestellt wird (Haber-
Bosch-Verfahren s.u.)
Pflanzen nehmen die wasserlöslichen Stickstoffverbindungen (Ammoniumsalze,
Nitrate) aus dem Boden auf und verwenden sie zur Synthese von pflanzlichen
eiweissstoffen. Tiere nehmen das pflanzliche Eiweiss mit der Nahrung auf und
wandeln es in tierische Eiweissstoffe um.
Eiweissstoffe werden im tierischen Organismus auch abgebaut, der Stickstoff wird
dann in Form von Harnstoff, OC(NH2)2, ausgeschieden. Dieser kann als Dünger
genutzt werden. Bei der Verwesung von toten Tieren und Pflanzen entsteht unter
anderem N2, der in die Luft entweicht.
| Erdkruste (%) | Vorkommen | |
|---|---|---|
| Stickstoff | 0,0046 | N2 (Luft), NaNO3 (Chile-Salpeter), Eiweissstoffe in Tieren und Pflanzen |
| Phosphor | 0,12 | Ca3(PO4)2 (Phosphorit), Ca5(PO4)3(OH,o. F,o. Cl) (Apatit) |
| Arsen | 5*10-4 | FeAsS (Arsenopyrit, Arsenkies), As4S4 (realgar), As2S3 (Auripigment), As4O6 (Arsenolith), elementares As (Scherbenkobalt), in Erzen als Verunreinigung von Sn, Pb, Co, Ni, Cu, Ag, Au, Zn |
| Antimon | 5*10-5 | Sb2S3 (Grauspiessglanz), Sb4O6 (Senarmontit), in Erzen von Pb, Cu, Ag, Hg |
| Bismut | 1*10-5 | Bi2S3 (Bismutglanz), Bi2O3 (Bismutocker), in Erzen von Sn, Pb, Co, Ni, Cu, Ag, Au |
Die Tabelle gibt eine Übersicht über die wichtigsten Vorkommen der Elemente der
fünften Hauptgruppe in der Natur.
Stickstoff wird zusammen mit Sauerstoff und den Edelgasen bei der fraktionierten
Destillation von flüssiger Luft erhalten. Er kommt in flüssiger Form (zu Kühlzwecken)
oder als komprimiertes Gas in grünen S
tahlflaschen in den Handel.
Sehr reiner Stickstoff entsteht bei der thermischen Zersetzung von Natriumazid
(NaN3) oder Bariumazid (Ba(N3)2).
Für den Laborbedarf kann Stickstoff durch Erwärmen einer gesättigten Lsg. von Ammoniumchlorid und Natriumnitrit hergestellt werden.
Phosphor wird technisch aus Phosphatmineralien hergestellt. Diese werden in einem elektrisch beheizten Ofen mit Sand (SiO2) und Koks bei etwa 1500°C umgesetzt. Bei der stark endothermen Reaktion entsteht Calciumsilicat und gasförmiger Phosphor und Kohlenmonoxid.
Arsen, Antimon und Bismut werden durch Reduktion ihrer Oxide mit Kohlenstoff bei höheren Temperaturen erhalten
Die Oxide erhält man durch Rösten der sulfidischen Erze an der Luft.
Arsen, Antimon und Bismut kommen in der Natur gelegentlich elementar („gediegen") vor, aber nur im Falle des Bismuts sind solche Erze abbauwürdig.
Zahlreiche Metalle reagieren mit Phosphor unter Bildung von Phosphiden, die das
Phosphidion P3- enthalten.
Metalle reagieren auch mit Arsen, Antimon und, in geringem Maße, mit Bismut; auch
hierbei entstehen dreifach negativ geladene Ionen des jeweiligen Elementes
(Arsenid, Antimonid, Bismutid). Galliumarsenid,Z.B., ist ein Halbleiter der bei der
Herstellung von Solarzellen zum Einsatz kommt (kam).
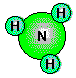 ist eine Verbindung, die technisch in grossem Maßstab hergestellt
wird. Die Synthese erfolgt nach dem Haber-Bosch-Verfahren durch direkte
Vereinigung der beiden Elemente.
ist eine Verbindung, die technisch in grossem Maßstab hergestellt
wird. Die Synthese erfolgt nach dem Haber-Bosch-Verfahren durch direkte
Vereinigung der beiden Elemente.
Dieses theoretisch einfache Verfahren wird in der Industrie durch einen komplizierten Großprozeß verwirklicht. Die Ausgangsstoffe H2 und N2 werden durch technisch aufwendige Prozesse unmittelbar vor der NH3-Synthese gewonnen. Bei einer Synthesemethode wird Wassergas (H2 + CO) und Generatorgas (2N2 + CO) verwendet; beide Gase werden abwechselnd im gleichen Reaktionsbehälter hergestellt. Beim Durchleiten von Luft durch Koks verbrennt dieser zu CO und heizt sich auf, Generatorgas entsteht; dann wird Wassersdampf durchgeleitet und in endothermer Reaktion entsteht Wassergas, der Koks kühlt sich ab. Das CO wird durch Konvertierung mit Wasserdampf zu H2 und CO2 umgesetzt, das CO2 wird dann herausgelöst.
Ammoniak ist ein farbloses Gas mit einem stechenden, charakteristischen Geruch, das beim Einatmen die Schleimhäute angreift. Beim Abkühlen auf -33,4°C kondensiert das Gas zu einer wasserähnlichen Flüssigkeit, die ein gutes Lösungsmittel ist
. In Wasser ist Ammoniak sehr gut löslich; bei 20°C und Normaldruck lösen sich etwa 700 Liter NH3-Gas in einem Liter Wasser. Die Lösung ist schwach basisch
Sowohl in Lösung wie auch als Gas reagiert Ammoniak mit Säuren, wobei Ammonium-Salze entstehen. (Ammoniak + Salzsäure <--> Ammoniumchlorid)
Stickstoffwasserstoffsäure, HN3, ist eine schwache Säure, die in wässriger Lösung aus ihren Salzen, den Aziden, durch Zusatz von Schwefelsäure gewonnen wird. reine HN3 ist eine flüchtige, sehr giftige und explosive Flüssigkeit. Schwermetallazide sind sehr brisant, Bleiazid, Pb(N3)2, wird als Initialzünder verwendet, d.h. zur Einleitung der Explosion von Sprengstoffen und Munition.
Phosphan (PH3, Phosphorwasserstoff) ist ein sehr giftiges, unangenehm riechendes, farbloses Gas, das bei der Hydrolyse von Phosphiden entsteht. Es bildet sich auch bei der Reaktion von weissem Phosphor mit konzentrierten Alkalihydroxidlösungen.
Arsan (AsH3, Arsenwasserstoff), Stiban (SbH3, Antimonwasserstoff) und Bismutan (BiH3, Bismutwasserstoff) sind sehr giftige Gase, die bei der Hydrolyse von Arseniden, Antimoniden oder Bismutiden entstehen. Sie haben keine basischen Eigenschaften und bilden keine Salze mit Säuren. AsH3 und SbH3 bilden sich auch bei der Einwirkung von „naszierendem Wasserstoff" auf Arsen bzw. Antimon.
Trihalogenide sind von allen Elementen der fünften Hauptgruppe bekannt (ausser
Astat).
Stickstofftrifluorid (NF3) ist ein farbloses, reaktionsträges Gas, das anders als
Ammoniak nicht wasserlöslich ist und keine basischen Eigenschaften hat. Im
Gegensatz zum NF3 sind die übrigen Stickstofftrihalogenide instabile, explosive
Substanzen. Da sowohl Ammoniak wie die Halogene gängige Laborchemikalien
sind, muß man sich der Gefahr bewußt sein, die bei deren Vermischung lauert.
NI3 * NH3 (Ammoniakat des Stickstofftriiodid) fällt zum Beispiel als schwerlösliche,
braun-schwarze Verbindung aus wässrigen NH3-Lösungen bei Zusatz von Iod aus;
im trockenen Zustand explodiert es bei der geringsten Berührung.
Pentahalogenide sind nicht von allen Elementen der fünften Hauptgruppe herstellbar. Bekannte Pentahalogenide sind: PF5, PCl5, PBr5, AsF5, AsCl5, SbF5, SbCl5, BiF5. Im flüssigen und gasförmigen Zustand bestehen die Pentahalogenide trigonal- bipyramidalen Molekülen. Festes PCl5 und PBr5 bilden dagegen Ionengitter. Alle Pentahalogenide sind Lewis-Säuren. Sie lagern leicht Halogenidionen an, wobei Hexahalogeno-Anionen entstehen.
Ox.Z.: +I. Distickstoffoxid,
![]()
auch Lachgas genannt, N2O wird durch vorsichtiges Erhitzen von geschmolzenem
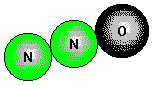 Ammoniumnitrat bei 200°C dargestellt. Bei Temperaturen von über 300°C kann die
Zersetzung des Ammoniumnitrats explosionsartig ablaufen.
Ammoniumnitrat bei 200°C dargestellt. Bei Temperaturen von über 300°C kann die
Zersetzung des Ammoniumnitrats explosionsartig ablaufen.
N2O ist ein farbloses, wenig reaktives Gas. Bei etwa 500°C zersetzt es sich in die Elemente. In geringen Mengen eingeatmet erzeugt es einen Rauschzustand. Medizinisch wird es im Gemisch mit Sauerstoff als Narkosemittel verwendet, außerdem dient es als Treibgas in Sprühflaschen von Schlagsahne.
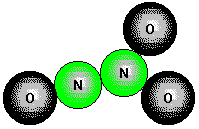
Ox.Z.: +II. Stickstoffmonoxid, NO,
![]()
entsteht bei sehr hohen Temperaturen aus den Elementen (künstlich [Lichtbogen],
 natürlich [Blitz]).
natürlich [Blitz]).
Im NO-Molekül ist eine ungerade Zahl von Elektronen vorhanden, ein Elektron muß somit ungepaart sein; aus diesem Grund ist NO paramagnetisch.
In Kontakt mit Sauerstoff reagiert NO bei Raumtemperatur sofort zu braunem NO2.
Stickstoffoxid (NO) spielt eine Schlüsselrolle beim Sauerstofftransport im Blut, haben Forscher der Duke-Universität in Durham herausgefunden. Das Gas reguliert nicht nur das Öffnen und Schließen der Blutgefäße, es wirkt auch auf die roten Blutkörperchen ein, die den Sauerstoff von der Lunge ins Gewebe bringen. Das schreiben die Wissenschaftler um Jonathan Stamler in einer Studie, die in der Juliausgabe 2002 des Fachblatts "Nature Medicine" erscheint. Die Ergebnisse könnten die bisher ungelöste Frage klären helfen, weshalb bei vielen Patienten ein hoher Sauerstoffgehalt im Blut keineswegs immer zu einer guten Sauerstoffversorgung des Gewebes führt. Ursache könnten Störungen im Stickstoffoxid-Haushalt sein – in den feinen Verästelungen der Blutgefäße kann dann nicht mehr genug Sauerstoff abgegeben werden. Neben Sauerstoff und Kohlendioxid sollten daher bei Intensivpatienten auch die Werte des Stickstoffoxids kontrolliert werden, empfehlen die Wissenschaftler. Die Entdeckung soll zudem helfen, Gefäßkrankheiten besser zu verstehen.
Ox.Z.: +III. Distickstofftrioxid, N2O3,
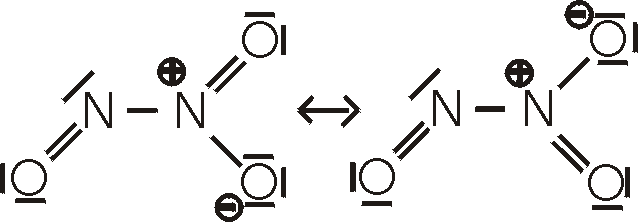
bildet sich als blaue Flüssigkeit wenn ein äquimolares Gemisch von NO und NO2 auf
 -20°C abgekühlt wird.
-20°C abgekühlt wird.
Die Verbindung ist unter normalen Bedingungen instabil und zerfällt wieder in seine Edukte.
Ox-Z.: +IV: Das monomere Stickstoffdioxid, NO2,
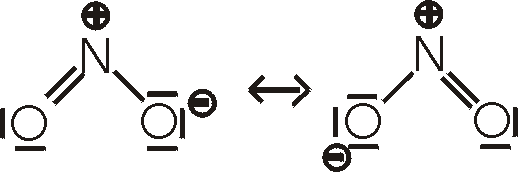
existiert in einem Gleichgewicht mit seinem Dimeren, dem Distickstofftetroxid, N2O4.
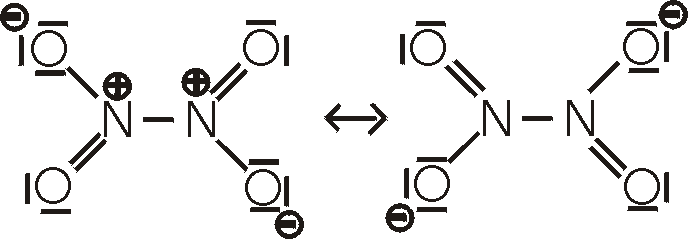
Stickstoffdioxid ist ein braunes, sehr giftiges und korrodierend wirkendes Gas. Es hat
eine ungerade Elektronenzahl und ist paramagnetisch. Das Dimer, bei dem die
Elektronen wieder gepaart sind, ist diamagnetisch und farblos. Je höher die
 Temperatur, desto mehr liegt das Gleichgewicht auf der Seite des NO2. Bei 135°C
besteht das Gas zu etwa 99% aus NO2. Beim Abkühlen kondensiert es bei 21°C zu
einer braunen Flüssigkeit, deren Farbe sich bei weiterer Abkühlung immer mehr
aufhellt. Beim Schmelzpunkt (-11°C) liegt der Großteil als N2O4 vor.
Stickstoffdioxid wird durch die Reaktion von Stickstoffmonoxid mit Sauerstoff
hergestellt.
Temperatur, desto mehr liegt das Gleichgewicht auf der Seite des NO2. Bei 135°C
besteht das Gas zu etwa 99% aus NO2. Beim Abkühlen kondensiert es bei 21°C zu
einer braunen Flüssigkeit, deren Farbe sich bei weiterer Abkühlung immer mehr
aufhellt. Beim Schmelzpunkt (-11°C) liegt der Großteil als N2O4 vor.
Stickstoffdioxid wird durch die Reaktion von Stickstoffmonoxid mit Sauerstoff
hergestellt.
Ox.Z.: +V. Distickstoffpentoxid, N2O5,
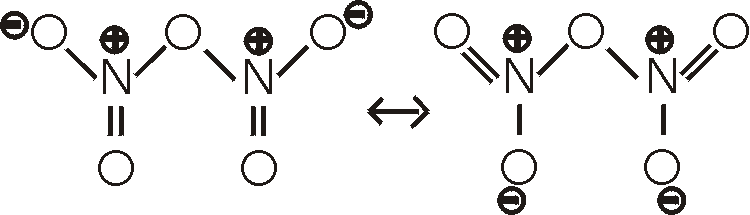
ist das Anhydrid der Salpetersäure; aus ihr wird es durch Dehydratisierung mittels
Phosphor(V)-oxid dargestellt.
N2O5 ist eine farblose, kristalline Substanz, die bei 32,5°C sublimiert.
 Der Dampf
besteht aus N2O5-Molekülen, die jedoch nicht sehr stabil sind und zu NO2 und O2
zerfallen. Im festen Zustand ist die Verbindung dagegen ionisch aus Nitryl-Ionen
NO2+ und Nitrat-Ionen NO3- aufgebaut.
Der Dampf
besteht aus N2O5-Molekülen, die jedoch nicht sehr stabil sind und zu NO2 und O2
zerfallen. Im festen Zustand ist die Verbindung dagegen ionisch aus Nitryl-Ionen
NO2+ und Nitrat-Ionen NO3- aufgebaut.
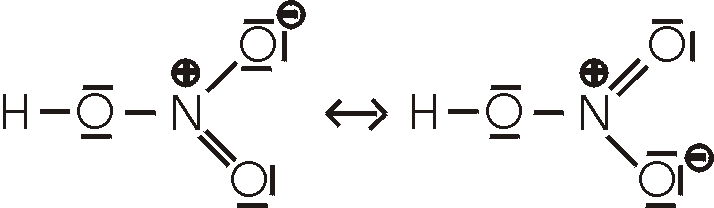
ist die wichtigste Oxosäure des Stickstoffs; in ihr hat der Stickstoff die Oxidationszahl +V. Salpetersäure wird techisch über das Ostwald-Verfahren hergestellt. Das durch die Ammoniak-Verbrennung gewonnene NO verbindet sich während der Abkühlung mit Sauerstoff zu NO2. Dieses Gas wird zusammen mit überschüssigem Sauerstoff durch Rieseltürme geleitet, in denen es mit Wasser reagiert. Dabei disproportioniert das NO2 zu Salpetersäure und NO; der überschüssige Sauerstoff oxidiert das NO sofort wieder zu NO2, das wie zuvor mit dem Wasser reagiert.
Reine Salpetersäure ist eine farblose Flüssigkeit, die bei 83°C siedet. Beim Stehen in
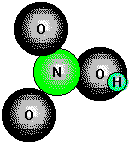 Licht zersetzt sie sich teilweise unter Bildung von NO2. Reine Salpetersäure kann
auch durch Erhitzen von Natriumnitrat mit konzentrierter Schwefelsäure hergestellt
werden.
Licht zersetzt sie sich teilweise unter Bildung von NO2. Reine Salpetersäure kann
auch durch Erhitzen von Natriumnitrat mit konzentrierter Schwefelsäure hergestellt
werden.
Salpetersäure ist nicht nur eine starke Säure, sondern auch ein kräftiges
Oxidationsmittel. Sie oxidiert die Mehrzahl der NIchtmetalle, wobei vielfach die Oxide
oder Oxosäuren in den höchsten Oxidationszuständen entstehen. Alle Metalle mit
Ausnahme von einigen Edelmetallen wie Gold und Platin werden oxidiert. Auch
Kupfer , Silber und Quecksilber, die von anderen Säuren nicht angegriffen werden,
lösen sich in Salpetersäure. Bei Oxidationsreaktionen mit Salpetersäure entsteht in
der Regel kein Wasserstoff. Die Salpetersäure wird vielmehr zu verschiedenen
Stickstoffverbindungen reduziert, in denen der Stickstoff eine niedrigere
Oxidationszahl hat.
Königswasser wirkt noch stärker oxidierend als Salpetersäure und greift auch Gold
und Platin an. Es handelt sich um ein Gemisch aus konzentrierter Salpetersäure und
konzentrierter Salzsäure im Molverhältniss 1 : 3. Seine Oxidationskraft ist auf die
Entwicklung von naszierendem Chlor zurückzuführen, das neben Nitrosylchlorid
(NOCl), entsteht.
ist die Oxosäure, in der Stickstoff die Oxidationszahl +III hat. Sie disproportioniert
sehr schnell, insbesondere in der Wärme. Aus diesem Grund läßt sich reine HNO2
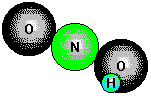 nicht isolieren. Wässrige Lösungen werden durch den Zusatz einer einer starken
Säure (z.B. Salzsäure) zu einer kalten wässrigen Lösung eines Nitrits (z.B. NaNO2)
hergestellt. Die Lösungen werden unmittelbar verwendet, ohne dass man versucht,
die Salpetrige Säure abzutrennen. Salpetrige Säure ist eine schwache Säure, die
sowohl als Reduktions- wie auch als Oxidationsmittel verwendet werden kann.
nicht isolieren. Wässrige Lösungen werden durch den Zusatz einer einer starken
Säure (z.B. Salzsäure) zu einer kalten wässrigen Lösung eines Nitrits (z.B. NaNO2)
hergestellt. Die Lösungen werden unmittelbar verwendet, ohne dass man versucht,
die Salpetrige Säure abzutrennen. Salpetrige Säure ist eine schwache Säure, die
sowohl als Reduktions- wie auch als Oxidationsmittel verwendet werden kann.
(Ortho-)Phosphorsäure
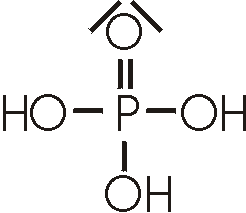
ist eine farblose, kristalline Verbindung, sie kommt aber in der Regel als 85%ige
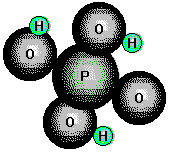 Lösung in den Handel. H3PO4 ist eine dreiprotonige Säure, die von ihr gebildeten
Salze heissen Phosphate.
Lösung in den Handel. H3PO4 ist eine dreiprotonige Säure, die von ihr gebildeten
Salze heissen Phosphate.
Phosphate sind wichtige Bestandteile in Düngemitteln. Phosphatmineralien sind zu schwer löslich in Wasser und können nicht direkt zu diesem Zweck verwendet werden. Das besser lösliche Calciumhydrogenphosphat [Ca(H2PO4)2] ist für Düngezwecke geeignet; es wird aus Phosphatmineralien durch Reaktion mit Säuren erhalten. Die Mischung aus Ca(H2PO4)2 und CaSO4 (Calciumsulfat) wird „Superphosphat" genannt. Ein besseres Düngemittel ist das calciumfreie „Tripelsuperphosphat", das durch Reaktion mit Phosphorsäure hergestellt wird
Ca3(PO4)2 + 2H2SO4 <--> Ca(H2PO4)2 + 2CaSO4
Superphosphat
Ca3(PO4)2 + 4H3PO4 <--> 3Ca(H2PO4)2
Tripelsuperphosphat
Da auch Nitate wichtige Bestandteile von Düngemitteln sind, erhält man ein sehr wirkungsvolles Düngemittel bei der Behandlung von Phosphatmineralien mit Salpetersäure („Nitrophosphate"). Wirkungsvoll sind auch Monoammoniumphosphat, NH4H2PO4, und Diammoniumphosphat (NH4)2HPO4, die aus Phosphorsäure und Ammoniak hergestellt werden.

|
Trivialname |
Formel |
Chemische Bezeichnung |
|
Stickstoffdüngemittel |
|
|
|
Ammonsalpeter |
NH4NO3 |
Ammoniumnitrat |
|
Ammonsulfat |
(NH4)2SO4 |
Ammoniumsulfat |
|
Chilesalpeter |
NaNO3 |
Natriumnitrat |
|
Harnstoff |
H2NCONH2 |
Harnstoff (Carbamid) |
|
Kalisalpeter |
KNO3 |
Kaliumnitrat |
|
Kalksalpeter |
Ca(NO3)2 |
Calciumnitrat |
|
Kalkstickstoff |
CaCN2 + C |
Calciumcyanamid + Kohlenstoff |
|
Phosphordüngemittel |
|
|
|
Superphosphat |
Ca(H2PO4)2 + 2 CaSO4 |
Calciumdihydrogenphosphat + Calciumsulfat |
|
Doppelsuperphosphat |
Ca(H2PO4)2 |
Calciumdihydrogenphosphat |
|
Rhenaniaphosphat |
CaNaPO4 + CaSiO3 |
Calcium-Natriumphosphat + Calciumsilicat |
|
Thomasmehl |
Ca3(PO4)2 + CaO |
Calciumphosphat + Calciumoxid |
|
Kalidünger |
|
|
|
Carnallit |
KCl * MgCl2 * 6 H2O |
Kalium-Magnesiumchlorid |
|
Kainit |
KCl * MgSO4 * 3 H2O |
Kaliumchlorid- Magnesiumsulfat |
|
Kalimagnesia |
K2SO4 * MgSO4 * 6 H2O |
Kalium-Magnesiumsulfat |
|
Mischdünger
(Volldünger) |
|
|
|
Nitrophoska |
NH4Cl + (NH4)2HPO4 + KNO3 |
Ammoniumchlorid + Diammoniumhydrogen- phosphat + Kaliumnitrat |
|
Hakaphos |
H2NCONH2 + KNO3 + (NH4)2HPO4 |
Harnstoff + Kaliumnitrat + Diammoniumhydrogen- phosphat |
H3PO4 + NH3 <--> NH4H2PO4 + NH3 <--> (NH4)2HPO4
Monoammoniumphosphat --> Diammoniumphosphat
Phosphorige Säure, H3PO3,
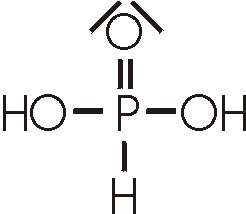
ist eine Oxosäure, in der Phosphor mit der Oxidationszahl +II vorliegt. Sie kann aus P4O6 und kaltem Wasser oder durch Hydrolyse von PCl3 dargestellt werden.
Obwohl das H3PO3-Molekül über drei Wasserstoffatome vefügt handelt es sich um eine zweiprotonige Säure.
In der Unterphosphorigen Säure, H3PO2,
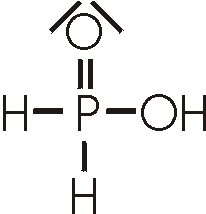
hat Phosphor die Oxidationszahl +I. Sie bildet weisse, farblose Kristalle und ist nur eine einprotonige Säure.
Die Zahl der Protonen, die von der Phosphorsäure, Phosphoriger Säure und Unterphosphoriger Säure abgegeben werden können, hängen mit ihrer Molekularstruktur zusammen. Nur H-Atome, die an O-Atome gebunden sind, haben sauren Charakter; diejenigen, die an das Phosphor-Atom gebunden sind, dissoziieren nicht in wässriger Lösung.
Oxide und Oxosäuren von Arsen, Antimon und Bismut spielen nur eine untergeordnete Rolle. Die Oxide biden sich beim Erhitzen von AS, Sb und Bi an der Luft. Die Oxide verbinden sich mit Wasser zu den entsprechenden Säuren.
Phosphor. Elementearer Phosphor wird überwiegend zur Herstellung von
Phosphor(V)-oxid, von reiner Phosphorsäure und von Phosphaten verwendet. In
kleineren Mengen dient es zur Herstellung von Streichhölzern und
Feuerwerkskörpern.
Die bedeutendste Produktklasse, die aus Phosphorsäure hergestellt wird, sind
Düngemittel.
Arsen, Antimon und Bismut und ihre Verbindungen werden heutzutage in der modernen Kommunikationstechnologie eingesetzt. Wohl fast alle wichtigen Telekommunikationslaser zur Datenübertragung bestehen hauptsächlich aus Arseniden (AlGaAs). Und Internet in seiner heutigen Form wäre ohne Arsenide auch undenkbar.
Sb und Bi dehnen sich beim Erstarren einer Schmelze aus und dringen in alle Ritzen einer Form. Niedrigschmelzende Antimon- und Bismut-Legierungen dienen als Verschlüsse für Sprinkleranlagen und von Sicherheitsventilen für Kessel, als Lötmetall und für elektrische Sicherungen. Arsenverbindungen werden in Giften zur Bekämpfung von Ratten und Insekten
eingesetzt.