| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
Die vierte Hauptgruppe des Periodensystems umfaßt die Elemente Kohlenstoff (C), Silicium (Si), Germanium (Ge), Zinn (Sn) und Blei (Pb). Die Zahl der Kohlenstoffverbindungen übersteigt bei weitem die Zahl der Verbindungen von jedem anderen Element, ausgenommen Wasserstoff. Es sind etwa zehn mal mehr Kohlenstoffverbindungen als kohlenstofffreie Verbindungen bekannt. Die Chemie der Kohlenstoffverbindungen, ist Gegenstand der organischen Chemie und wird dort ausführlich behandelt. Die Chemie von Zinn und Blei wird im Kapitel „Metalle" besprochen.
Im elementaren Kohlenstoff werden die Atome in einem ausgedehnten Netzwerk durch kovalente Bindungen zusammengehalten. Um diese Bindungen aufzubrechen, ist ein großer Energiebetrag notwendig; Kohlenstoff hat deshalb den höchsten Schmelz- und Siedepunkt dieser Gruppe. Beim Übergang zu den schwereren Elementen nimmt der kovalente Charakter der Bindungen ab und die für die Metalle typischen Bindungskräfte gewinnen an Bedeutung. Parallel dazu nehmen die Schmelz- und Siedepunkte ab und die elektrische Leitfähigkeit nimmt zu.
| Kohlenstoff | Silicium | Germanium | Zinn | Blei | |
|---|---|---|---|---|---|
| Smp.°C | 3750 | 1420 | 959 | 232 | 327 |
| Sdp.°C | 3370 | 2355 | 2700 | 2260 | 1751 |
| Radius (Kov) | 77 pm | 117 pm | 122 pm | 1141 pm | 154 pm |
| Elektroneg. | 2,6 | 1,9 | 2,0 | 2,0 | 2,3 |
In der Mehrzahl der Verbindungen der Elemente der vierten Hauptgruppe liegen
kovalente Bindungen vor. Durch die Bildung von vier kovalenten Bindungen wird eine
Elektronenkonfiguration erreicht, die des folgenden Edelgases entspricht. Im Falle
des Kohlenstoffes ist damit die Maximalzahl der möglichen kovalenten Bindungen
ausgeschöpft. Bei den übrigen Elementen können jedoch noch „innere Schalen"
(d-Orbitale) aufgefüllt werden und mehr als vier kovalente Bindungen sind möglich
(meistens sechs).
Kohlenstoff zeichnet sich durch seine besondere Fähigkeit aus, Verbindungen zu
bilden, in denen viele Kohlenstoffatome miteinander zu Ketten oder Ringen
verbunden sind. Diese Tendenz der Verknüpfung gleicher Atome, nimmt mit
steigender Ordnungszahl deutlich ab. Im Falle des Kohlenstoffes scheint es
allerdings keine Grenzen zu geben, wie viele C-Atome zu Ketten verknüpft werden
können. Eine weiter Eigenschaft des Kohlenstoffes, die bei den anderen Elementen
der vierten Hauptgruppe nur sehr gering ausgeprägt ist, ist die Fähigkeit
Mehrfachbindungen einzugehen (Doppel- u. Dreifachbindungen).

Dementsprechend ist Diamant extrem hart, sehr stabil, hat einen sehr hohen
Schmelzpunkt und leitet den elektrischen Strom nicht. Er besteht aus farblosen
transparenten Material.
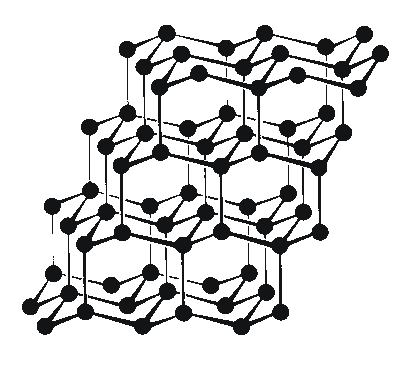
Das Netzwerk der Kohlenstoffatome im Diamant kann als ein System von
dreidimensional verknüpften, gewellten Sechsecken beschrieben werden;
die Sechsecke sind von der gleichen Art wie in der Verbindung Cyclohexan, C6H12, in
der sogenannten Sesselkonfiguration
Graphit ist ein weicher, schwarzer Festkörper mit einem gewissen metallischen Glanz. Ein Graphit-Kristall ist aus ebenen Schichten aufgebaut, in denen regelmäßige Sechsecke aus C-Atomen in der Art einer Bienenwabe verknüpft sind.
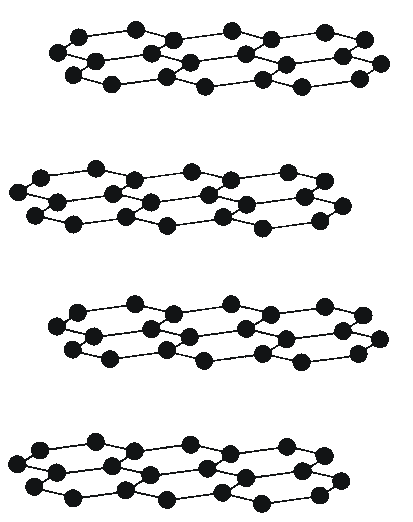
Die parallel gestapelten Schichten werden nur durch relativ schwache London'sche
Kräfte zusammengahalten. Die Schichten lassen sich relativ einfach gegeneinander
verschieben; deshalb ist Graphit weich und als Schmiermittel verwendbar. Graphit
hat eine geringere Dichte als Diamant.
In einer Schicht im Graphit ist jedes C-Atom an drei andere C-Atome gebunden, und
alle Bindungen sind gleichartig.
Je nach Herstellungsbedingungen kann Kohlenstoff mehr oder weniger gut graphitartig kristallin sein. Manche Koksarten, Pyrokohlenstoff und Aktivkohle sind mikrokristallin. In anderen Koksarten und im Ruß ist die Graphitstruktur stark gestört; kleinere Bruchstücke von Graphitschichten sind regellos orientiert, wobei an den Kanten der Schichtstücke Wasserstoffatome gebunden sein können.
Forscher um Lars Hultman stellten in ihrem Experiment eine spezielle Art von Fullerenen her, bei denen jeweils zwölf der sechzig Kohlenstoffatome eines Fullerens
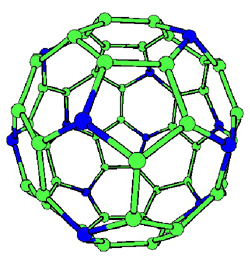
durch Stickstoff ersetzt wurden. Dazu benutzten sie eine als "sputtering" bezeichnete Herstellungstechnik, bei der die Fullerene aus einem Gasgemisch aus Kohlenstoff und Stickstoff synthetisiert werden. Das so hergestellte Material besteht aus konzentrischen Kugeln, die sich wie die Häute einer Zwiebel anordnen, und deren innerer Kern aus einem Fulleren mit zwölf Stickstoffatomen besteht. Zwischen den kugelartigen Anordnungen wirken starke kovalente Bindungen, was dem Material eine größere Härte als dem oft in der Technik eingesetzten Titaniumnitrid verleiht. Daneben zeichnet sich das Material allerdings auch durch eine hohe Elastizität aus und scheint daher für Anwendungen prädestiniert, die hochbelastbare Materialien erfordern.
Silicium tritt mit der gleichen Struktur wie Diamant auf; eine graphitartige Modifikation ist nicht bekannt. Kristallines Silicium ist grau glänzend und ein elektrischer Halbleiter. Die Bindungen im Silicium sind weniger stark als im Diamant und Bindungselektronen können thermisch angeregt werden, so daß sie im Kristall beweglich werden.
Germanium hat ebenfalls Diamantstruktur und ist ein Halbleiter. Zinn hat bei Temperaturen über 13°C eine Metallstruktur, unterhalb von 13°C wandelt es sich sehr langsam in eine halnmetallische Modifikation mit Diamantstruktur um. Zinngegenstände können deshalb bei anhaltender Kälte im Winter zu einem grauen Staub zerfallen. Blei kristallisiert mit der für Metalle typischen, kubisch-dichtesten Kugelpackung.
Zu etwa 98% reiner Kohlenstoff wird in Form von Koks aus Steinkohle und aus den Rückständen der Erdölraffination gewonnen. Dies geschieht durch Erhitzen unter Luftausschluß, wobei sich die in der Kohle enthaltenen organischen Verbindungen verflüchtigen und das Kokereigas und den Steinkohleteer bilden. Künstlicher Graphit wird durch ein- bis dreiwöchiges Erhitzen von Koks auf 2600 bis 3000°C in inerter Atmosphäre hergestellt. Bei der hohen Temperatur wird erreicht, daß der Kohlenstoff besser kristallisiert. Natürlicher und künstlicher Graphit findet vielfach Anwendung als Material für Elektroden, für Bürsten in Elektromotoren, für chemische Apparate und für Metallgießformen
Pyrokohlenstoff ist ein weiterer temperaturbeständiger Werkstoff, der durch
Zersetzung von Kohlenwasserstoffen bei hohen Temperaturen unter Luftausschluß
erhalten wird.
Ähnlich erfolgt auch die Herstellung von Kohlenstofffasern, indem unter Zug
stehende Fasern aus organischen Verbindungen erhitzt werden. In Kunststoff
eingelagerte Kohlenstofffasern dienen zur Herstellung von mechanisch stark
beanspruchten Gegenständen wie Flugzeugturbinen oder auch Tennischlägern.
Aktivkohle ist ein sehr poröser Kohlenstoff mit einer außerordentlichen großen Oberfläche. Sie entsteht beim Erhitzen von Holz, Torf und anderen organischen Materialien unter Luftausschluß im Beisein von Phosphorsäure oder Zinkchlorid. Diese Zusätze sorgen für die Bildung zahlreicher Poren. Wegen ihrer großen Oberfläche vermag Aktivkohle ander Stoffe physikalisch zu adsorbieren und dient deshalb zur Entfernung von Verunreinigungen aus Lösungen und als Filtermaterial in Gasmasken.
Ruß wird technisch durch unvollständige erbrennung von Erdöl, Erdgas oder Acetylen hergestellt. Die Hauptmenge wird als Füllstoff im Gummi für Autoreifen verarbeitet, Außerdem dient er als Pigment in Lacken, Tinten und Druckerschwärze.
Silicium wird technisch durch Reduktion von Quarz mit Koks bei Temperaturen von über 2000°C im elektrischen Lichtbogen-Ofen dargestellt.
Salzartige Carbide bestehen aus Metall-Kationen und Anionen, die nur Kohlenstoff enthalten.
Silicium löst sich in den Schmelzen der meisten Metalle, wobei in vielen Fällen definierte Verbindungen die Silicide gebildet werden (z.b.: Mg2Si, CaSi, CaSi2, Ba3Si4,...). Obwohl die Bindung zwischen den Metall- und Siliciumatomen keine reine Ionenverbindungen sind, verhalten sich viele Siicide salzartig.
Silane sind Verbindungen der allgemeinen Formel SinH2n+2; Verbindungen mit n = 1 bis n = 6 sind bekannt. in ihren Molekularstrukturen entsprechen sie den Alkanen. Silane sind wesentlich reaktiver als Alkane; sie sind in der Luft selbstentzündlich.
Kohlenmonoxid ist ein farb- und geruchloses, giftiges Gas, das sich in Wasser nur geringfügig löst.

An Luft brennt Kohlenmonoxid in einer stark exothermen Reaktion; es kann deshalb als Brennstoff verwendet werden. Es wird bei der Gewinnung von Metallen aus Metalloxiden als Reduktionsmittel eingesetzt.
Kohlendioxid ist das Reaktionsprodukt der vollständigen Verbrennung aus Kohlenstoff und Kohlenstoffverbindungen. Es entsteht auch bei der Zersetzung von Carbonaten bei Zusatz von Säuren oder bei deren Erhitzung.
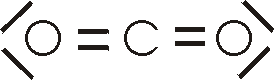
Im Sauerstoff-Kohlendioxid-Zyklus wird durch die Atmung von Tieren, der
Verbrennung von Brennstoffen und dem Zerfall von organischer Materie bei
Fäulnissprozessen der Atmosphäre ständig Sauerstoff entzogen und Kohlendioxid
zugeführt. Der umgekehrte Prozess läuft bei der Photosynthese ab. Pflanzen
entnehmen der Luft CO2 und bauen damit Kohlenhydrate auf, wobei O2 an die Luft
abgegeben wird. Die Photosynthese wird durch das Chlorophyll katalysiert und das
Sonnenlicht liefert die nötige Energie.
Die Löslichkeit von CO2 im Meerwasser und das geochemische Gleichgewicht
zwischen CO2, H2O, und Kalkstein, CaCO3, haben ebenfalls Einfluß auf den
CO2-
Gehalt der Luft.
Viele natürliche Mineralwasser enthalten Kohlensäure. In Selterswasser wird
Kohlendioxid unter Druck eingepreßt, dabei wird das Gas im Wasser gelöst. Beim
Öffnen und Schließen einer Sprudelflasche beobachtet man, daß sich Gasblasen
bilden und wieder verschwinden.
Auch wenn Selterswasser erwärmt wird entweichen Gasblasen, die mit Kalkwasser
als Kohlendioxid nachweisbar sind.
Geben wir in Mineralwasser einen Indikator kann man einen sauren pH feststellen.
Je mehr Gas (CO2) aus dem Wasser entweicht desto mehr zeigt der Indikator einen
neutralen pH.
Zuerst entweicht das gelöste Kohlendioxid, dann zerfällt die Kohlensäure in Wasser
und Kohlendioxid.
Wärme mindert die Löslichkeit von Gasen in Wasser. Druck erhöht die Löslichkeit von Gasen in Wasser.
Diese Umkehrreaktion wird wie folgt dargestellt:
Wenn Kohlendioxid in je einem Steigrohr durch Natronlauge und Wasser geleitet,
werden die Gasblasen in der Natronlauge immer kleiner während sie im Wasser
nahezu gleich bleiben.
Kohlendioxid reagiert mit Natronlauge. Es entsteht Natriumcarbonat (Soda).
Brausepulver ist ein Gemisch aus Natriumhydrogencarbonat, Citronensäurekristallen
und Zucker. Schüttet man das Pulver in Wasser, so bildet sich eine saure Lösung,
die aus dem Carbonat Kohlendioxid austreibt.
Backpulver gibt während des Backvorgangs Kohlendioxid ab. Dieses bildet die Poren
im Gebäck.
Kohlendioxid kann mit Kalkwasser nachgewiesen werden. Es bildet sich eine trübe Lösung; wenn diese eingedampft wird bleibt ein Salz zurück. Es ist Calciumcarbonat.
Wenn in die Calciumcarbonatlösung (trübe Lösung s.o.) weiteres CO2 eingeleitet wird, klärt sie sich wieder auf. Das schwer lösliche Calciumcarbonat wandelt sich mit Kohlendioxid in wasserlösliches Calciumhydrogencarbonat (Ca(HCO3)2 um.
Erhitzt man eine klare Calciumhydrogencarbonatlösung, so entweicht Kohlendioxid. Die Flüssigkeit wird trübe. Dabei hat sich unlösliches Calciumcarbonat gebildet. Abhängig von der Temperatur und dem Druck bleibt es im Wasser gelöst (warm + kein Druck) oder es fällt aus (kalt + Druck). Es stellt sich ein Gleichgewicht ein:
In SiO2-Kristallen ist jedes Si-Atom an vier Sauerstoffatome gebunden und jedes Sauerstoffatom verbindet zwei Siliciumatome.
Siliciumdioxid ist in sehr geringem Maße in Wasser löslich; die Lösung enthält Monokieselsäure, H4SiO4. Alle natürlichen Gewässer enthalten diese sehr schwache Säure in geringer Menge (~ 10 mg/l). Nur sehr verdünnte Lösungen sind stabil.
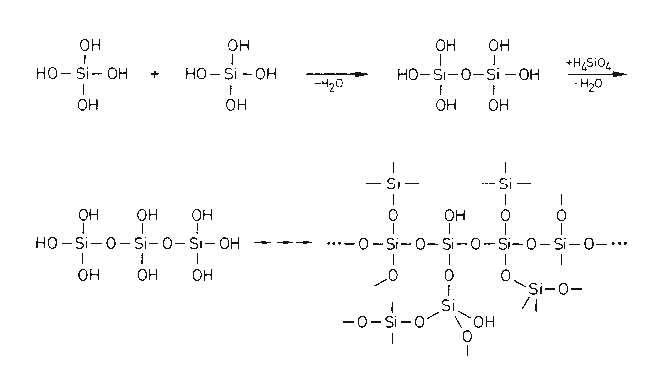
Getrocknetes Kieselgel ist eine amorphe Form von SiO2 mit einem ungeordnet verknäulten Netzwerk, bei dem noch einzelne OH-Gruppen vorhanden sind und wechselnde Mengen von Wasser eingelagert sind. Kieselgel ist sehr porös und hat ähnlich wie Aktivkohle ein hohes Adsorptionsvermögen. Es findet Verwendung zur Adsorption von unerwünschten Dämpfen, in der Dünnschichtchromatographie und als Trocknungsmittel.
Silicate sind die Salze der Monokieselsäure und der Polykieselsäuren. Silicate entstehen beim Zusammenschmelzen von SiO2 mit Metalloxiden, -hydroxiden oder- carbonaten.
.
| Typ | Formel des Anions | Bsp.für Mineralien |
|---|---|---|
| Inselsilicate | SiO44- | Olivin (Mg,Fe)2[SiO4]; Granat Mg3Al2[SiO4]3; Zirkon Zr[SiO4] |
| Gruppensilicate | Si2O76- | Thortveitit Sc2[Si2O7] |
| Ringsilicate | Si3O96-Si6O1812- | Wollastonit Ca3[Si3O9]; Beryll Be3Al2[Si6O16] |
| Kettensilicate | (SiO32-)n | Pyroxene, z.B. Enstatit Mg[SiO3] |
| Bandsilicate | (Si4O116-)n | Amphibole z.B.TremolitMg5Ca2(OH)2[Si4O11]2 |
| Schichtsilicate | (Si2O52-)n (AlSi3O105-)n | KaolinitAl2(OH)4[Si2O5];Talk Mg3(OH)2[SiO5]2 Glimmer, z.B. Muskovit KAl2(OH)2[AlSi3O10] |
| Gerüstsilicate | (AlSi3O8-)n (AlSiO4-)n (AlSi2O6-)n | Feldspäte, z.B. Orthoklas K[AlSi3O8]; Anorthit Ca[AlSiO4]2 Zeolithe, z.B. Chabasit Na2-2xCax[AlSi2O6]2*6H2O |
Bei manchen Silicaten treten zusätzlich zum Silicatanion noch OH--Ionen auf. Die Struktur eines Silications spiegelt sich in den Eigenschaften wider. Tonmineralien wie Kaolinit sind Schichtsilicate; sie können wechselnde Mengen Wasser zwischen den Schichten aufnehmen und dabei aufquellen.
Einzelne Siliciumatome in einem Silication können durch Aluminiumatome ersetzt sein. Solche Silicate nennt man Alumosilicate oder Aluminosilicate. Da ein Aluminiumatom ein Valenzelektron weniger als ein Siliciumatom einbringt, muß das Aluminosilication zur Wahrung der Elektronenstruktur pro Aluminiumatom eine zusätzliche negative Ladung haben. Glimmer ist hierfür ein Beispiel. Wenn jeweils alle vier Sauerstoffatome der SiO4-Tetraeder als Brückenatome auftreten, resultiert das dreidimensionale Gerüst einer SiO2-Struktur.