| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|

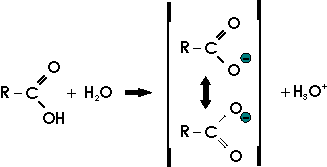
Ein Vergleich der Säurestärke in der folgenden Reihe zeigt den Einfluß der Polarität auf die Leichtigkeit, mit der das Proton vom Sauerstoffatom der Hydroxylgruppe abgetrennt werden kann:
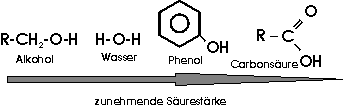
Umgekehrt bewirken elektronegative Atome oder Atomgruppen eine Verstärkung der Polarität der O-H-Bindung und erhöhen somit die Säurestärke. Trichloressigsäure oder gar Trifluoressigsäure sind in ihrer Stärke durchaus mit den starken anorganischen Säuren vergleichbar.
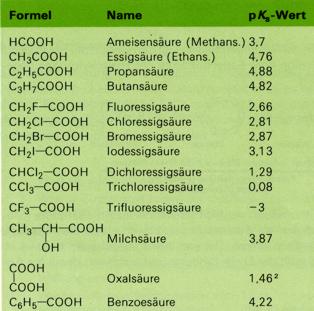
Für die quantitative Erfassung der Säurestärke (Acidität) wird meist der negative dekadische Logarithmus des Zahlenwertes der Säurekonstante (des KS-Wertes), der sogenannte pKS-Wert verwendet. Die Tabelle zeigt die pKS-Werte einiger organischer Säuren.
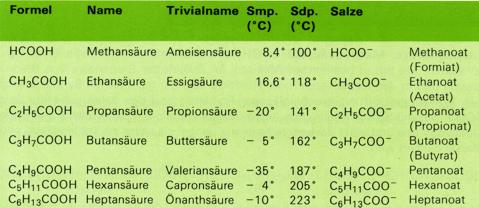
Die Eigenschaften der niedrigen Säuren werden durch die Carboxylgruppe bestimmt. die ersten vier Säuren lösen sich in jedem Verhältnis in Wasser und reagieren (ziemlich schwach) sauer. Die höheren Säuren (ab etwa sechs C-Atomen) sind in Wasser praktisch unlöslich; die lipophilen Eigenschaften der Kohlenwasserstoffreste überwiegen immer mehr. Ihr saurer Charakter wird wegen der Ünlöslichkeit in Wasser nur bei der Reaktion mit starken Basen offenbar, z.B. bei der Neutralisation mit Natrium- oder Kaliumhydroxid.
Ameisensäure, Essigsäure und Propionsäure sind stechend riechende , farblose Flüssigkeiten. Die Säuren mit vier bis acht Kohlenstoffatomen sind dickflüssiger und riechen unangenehm schweißartig bis ranzig. Säure mit mehr als zehn Kohlenstoffatomen sind weiche , paraffinartige, in lipophilen Lösungsmitteln leichtlösliche Substanzen ("Fettsäuren"). Die Siedepunkte steigen innerhalb der homologen Reihe regelmäßig an, liegen jedoch noch höher als bei Alkoholen von entsprechender Molekülmasse.
Die Moleküle der Carbonsäuren können unter sich zwei Wasserstoffbrücken bilden und assoziieren dadurch zu ziemlich stabilen "Doppelmolekülen", die nach Dampfdichtemessungen sogar im Dampfzustand erhalten bleiben.

Im festen Zustand liegen die Säuren ebenfalls dimerisiert, also als Doppelmolekül vor. Die Säuren mit einer geraden Zahl von Kohlenstoffatomen können dabei eine symetrischere und dichtere Anordnung bilden und schmelzen deshalb jeweils etwas höher als die Säuren mit ungeraden Kohlenstoffzahlen.
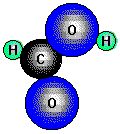 Hohltiere auf. Zur technischen Synthese setzt man Kohlenmonoxid mit geschmolzenem Ätznatron und das
dabei gebildete Salz HCOO-Na+ mit Schwefelsäure um. Ameisensäure enthält in ihrem Molekül auch
eine Aldehydgruppe und wirkt deshalb reduzierend, wobei sie selbst zu Kohlendioxid und Wasser oxidiert wird.
Hohltiere auf. Zur technischen Synthese setzt man Kohlenmonoxid mit geschmolzenem Ätznatron und das
dabei gebildete Salz HCOO-Na+ mit Schwefelsäure um. Ameisensäure enthält in ihrem Molekül auch
eine Aldehydgruppe und wirkt deshalb reduzierend, wobei sie selbst zu Kohlendioxid und Wasser oxidiert wird.
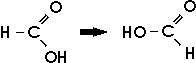
Beim Erwärmen mit konzentrierter Schwefelsäure zerfällt die Ameisensäure in Kohlenmonoxid und Wasser.
Essigsäure, Ethansäure, CH3COOH, eine der wichtigsten organischen Säuren, entsteht
durch Oxidation von Ethylalkohol über Acetaldehyd als Zwischenprodukt.
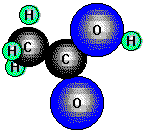 In kleineren Mengen ist Essigsäure im Holzteer enthalten. Die Hauptmenge der technisch hergestellten Essigsäure wird
aus Ethin oder Ethen gleichfalls über Acetaldehyd gewonnen.
In kleineren Mengen ist Essigsäure im Holzteer enthalten. Die Hauptmenge der technisch hergestellten Essigsäure wird
aus Ethin oder Ethen gleichfalls über Acetaldehyd gewonnen.
Die Essigsäure als Hauptbestandteil des Speiseessigs entsteht durch bakterielle Oxidation des Alkohols vergorener Fruchtsäfte oder von Wein. Diese sogenannte "Essiggärung" bildet den Dissimilationsvorgang der Essigbakterien. Im Gegensatz zur alkoholischen Gärung unterbleibt die Essiggärung bei Luftabschluss, weil Sauerstoff als Wasserstoffakzeptor oder Oxidationsmittel notwendig ist:
Reine Essigsäure ("Eisessig") erstarrt bei 16,6°C zu einer eisartigen, festen Masse. Sie ist ein wichtiges Zwischenprodukt zur Herstellung ihrer Salze, zur Darstellung ihrer Ester (z.B Celluloseacetat) und wird überall dort verwendet, wo eine billige organische oder schwache Säure gebraucht wird.
Buttersäure, Butansäure, C3H7COOH, kommt als Glycerinester in der Butter vor. Ranzige Butter und Schweiss enthalten geringe Mengen der freien Säure. Durch bestimmte Bakterien können Kohlenhydrate zu Buttersäure vergoren werden. Im Gegensatz zur Säure besitzen ihre Ester oft einen angenehm-fruchtartigen Geruch (Verwendung als Aromastoffe).
Die eigentlichen Fettsäuren, Laurinsäure (C11H23COOH), Palmitinsäure (C15H31COOH) und Stearinsäure (C17H35COOH) bilden als Glycerinester den Hauptanteil pflanzlicher und tierischer Fette.
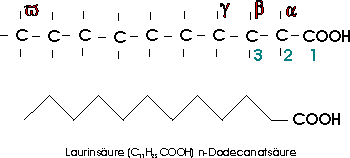
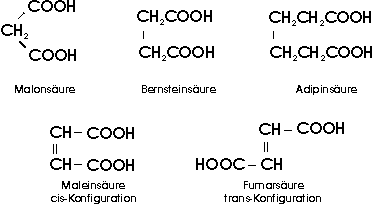
Die Numerierung der C-Atome ist zweideutig, die alte Bezeichnung mit griechischen Buchstaben beginnt mit der
Zählung am ersten C-Atom (Alpha-C) nach der Carboxylgruppe, hierbei wird dem letzten C-Atom
in der Kette immer der Buchstabe "Omega" gegeben.
Die Nummerierung mit arabischen Zahlen beginnt mit dem C-Atom der Carboxylgruppe und endet
numerisch beim letzten C-Atom der Kette.
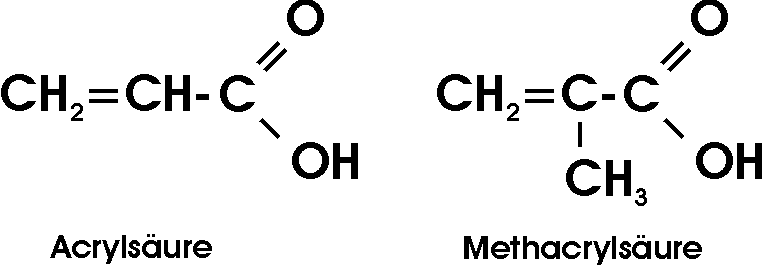
Von den ungesättigten Carbonsäuren besitzt die Acrylsäure sowie die Methacrylsäure zur Herstellung glasartiger Polymerisate große Bedeutung. Plexiglas ist ein polymerer Methacrylsäureester.
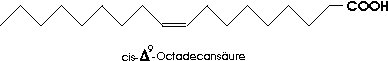
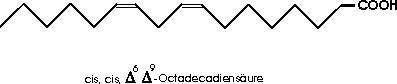
Höhere ungesättigte Carbonsäuren wie Ölsäure (mit einer Doppelbindung) und Linolsäure (mit zwei Doppelbindungen) treten ebenfalls als Glycerinester in Fetten und "fetten Ölen" auf (Olivenöl, Leinöl u.a.).
Milchsäure, alpha-Hydroxypropansäure, entsteht aus Zucker durch "Milchsäuregärung", die durch
bestimmte Bakterien hervorgerufen wird, und tritt in saurer Milch, in Sauerkraut, in altem Käse u.a. auf. Im
arbeitenden Muskel entsteht aus Glykogen freie Milchsäure, wenn die Sauerstoffzufuhr nicht ausreichend ist.
Weinsäure kommt als saures Kaliumsalz im "Weinstein" vor, der sich als schwerlösliches Salz in
Wein bei längerem Stehen ausscheidet und den Hauptanteil des "Satzes" von altem Wein bildet. Das Anion
der Weinsäure bildet mit Kupfer(II)-Ionen Komplexe, die auch in alkalischer Lösung, also bei hohen pH-Werten,
noch stabil sind.
Die drei-protonige Citronensäure ist ebenfalls eine Hydroxysäure. Sie kommt nicht nur in Zitronen,
sondern auch in vielen anderen Pflanzen (vor allem Früchten) vor, z.B. in Johannisbeeren und Stachelbeeren.
Milchsäure, Weinsäure und Citronensäure sind bei Zimmertemperatur feste, gut wasserlösliche Substanzen
von stark hydrophilem Charakter. Es sind stärkere Säuren als die normalen Carbonsäuren. Verwendung u.a.
zur Herstellung von Limonaden.
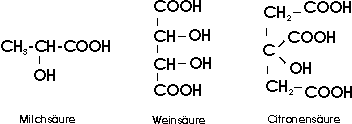
Durch Kochen mit Wasser können Ester wieder in Säure und Alkohol gespalten ("verseift") werden. Die Esterbildung ("Veresterung") verläuft also umkehrbar und führt gewöhnlich zu typischen Gleichgewichten, in welchen sowohl Alkohol wie Säure neben Ester und Wasser noch in erheblichen Mengen vorhanden sind. Die Einstellung des Gleichgewichtszustandes dauert meist sehr lange, kann aber durch katalytische Wirkung von Protonen (aus H2SO4 konz. oder HCl-Gas) stark beschleunigt werden. Die Hydrolyse des Esters wird durch Protonenspender ebenfalls beschleunigt. Meistens spaltet man allerdings Ester durch Kochen mit Lauge, wobei die Hydroxid-Ionen den entstehenden Säuremolekülen Protonen entziehen und sie als Anionen aus dem Gleichgewicht entfernen, so daß die Esterspaltung (die "Verseifung") dann praktisch vollständig verläuft:
Die Veresterung bildet ein Beispiel einer nucleophilen Addition, indem sich zuerst ein Alkoholmolekül an das positiv polarisierte Kohlenstoffatom der Carboxylgruppe anlagert.
Man benennt die Ester vielfach ähnlich wie Salze: Methylacetat für Essigsäuremethylester, Ethylbutyrat für Buttersäureethylester usw.
Ester niederer Carbonsäuren mit niederen Alkoholen (C1 bis C5) sind ziemlich stark flüchtig und durch einen angenehm, fruchtartigen Geruch ausgezeichnet. Manche von ihnen kommen in geringen Mengen in reifen Früchten vor ("Fruchtester") und werden als Aromastoffe für Limonaden und Bonbons aber auch als Lösungsmittel für Lacke verwendet.
Wachse sind Ester höherer Carbonsäuren mit höheren Alkoholen. Bienenwachs enthält hauptsächlich Säuren und Alkohole mit 26 und 28 Kohlenstoffatomen.
Die Fette und fetten Öle sind Glycerinester höherer Carbonsäuren.
Durch Hydrolyse ("Verseifung") der Fette mit Natron- oder Kalilauge entstehen die Alkalisalze der höheren Fettsäuren, die allgemein als Seifen bezeichnet werden und als waschaktive Substanzen große Bedeutung erlangt haben.