| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
Die Chemie der Kohlenwasserstoffe wird aus historischen Gründen meist als „organische Chemie“ bezeichnet. Der Ausdruck weist auf Beziehungen zu pflanzlichen und tierischen Organismen hin, obwohl zahlreiche organische Verbindungen nichts mit Lebewesen zu tun haben und organische Verbindungen schon existierten, bevor Leben auf der Erde entstand.
Viele organische Stoffe sind seit langem bekannt. Unsere Ahnen kannten bereits Zucker, die Herstellung von alkoholischen Getränken oder Essig und verschiedene Farbstoffe. Diese Methoden konnten unter den damaligen Bedingungen zwar nicht erklärt aber genutzt werden.
Erst in der Neuzeit mit den Anfängen der Chemie, konnten organische Stoffe aus den in der Natur vorliegenden Gemischen getrennt werden. Zitronensäure aus Zitronen, Apfelsäure aus Äpfeln usw..
Lavoisier erkannte durch seine „Verbrennungs-Versuche“, dass die meisten Naturverbindungen aus ganz wenigen Elementen bestehen.
Bis ins 19.Jhr. hielt man es für unmöglich diese Naturverbindungen zu synthetisieren. Sie würden in Lebewesen durch die Wirkung einer geheimnisvollen Lebenskraft (vis vitalis; Vitalismus) entstehen, war die anerkannte Lehrmeinung. Erst 1828 gelang es, Harnstoff, eine typische organische Verbindung, aus Ammoniumcyanat, künstlich herzustellen.
Im Laufe der Zeit stellte man fest, dass alle organischen Verbindungen Kohlenstoff enthalten, und stellte auch gewisse Besonderheiten in ihrem Aufbau und ihren Eigenschaften fest, so dass die Bezeichnung „Organische Chemie“ für die Chemie der Kohlenstoffverbindungen beibehalten wurde.
Neben Kohlenstoff sind nur wenig andere Elemente am Aufbau der Verbindungen beteiligt (im wesentlichen sind das: Kohlenstoff (C), Wasserstoff (H), Sauerstoff (O), Stickstoff (N), Phosphor (P), Schwefel (S); zusammen bilden die Symbole das Wort CHONPS; seltener Halogene, Metalle, u.a.). Trotzdem kennt man viel mehr organische als anorganische Verbindungen (mehr als 3.000.000 gegenüber 80.000). Diese Vielfalt liegt am besonderen chemischen Verhalten des Kohlenstoffatoms.
Kohlenstoffatome verbinden sich mit Atomen anderer Elemente durch kovalente Bindungen. Durch diese Atombindungen mit anderen nichtmetallischen Elementen (selten auch Metalle) entstehen Moleküle.
Die Besonderheit im Verhalten des Kohlenstoffs besteht darin, dass sich seine Atome in solchen Molekülen praktisch unbegrenzt mit sich selbst zu Ketten, Ringen, Netzen oder 3D-Gerüsten verbinden können. Zudem können sie untereinander Doppel- und Dreifachbindungen eingehen.
Die C-C Bindung ist bei normaler Temperatur beständig. Sie binden neben anderen Kohlenstoffatomen meistens nur Wasserstoffatome, daraus ergibt sich eine maximale Symmetrie der Ladungsverteilung und eine größtmögliche Abschirmung des Kohlenstoffrumpfes, wie es sonst bei keinen anderen Wasserstoffverbindungen des Periodensystems der Fall ist. Reaktionen an gewöhnlichen C-C oder C-H Bindungen benötigen eine relativ große Aktivierungsenergie; diese Bindungen sind damit kinetisch inert.
Eine weiter charakteristische Eigenschaft der meisten organischen Verbindungen ist ihre geringe Wärmebeständigkeit. Fast alle verbrennen oder verkohlen bereits beim Erwärmen auf wenige 100°C. Diese geringe thermische Stabilität ist auf den wenigen oder gar nicht polaren Charakter der C-C und der C-H Bindungen zurückzuführen.
Nahezu alle organischen Verbindungen sind metastabil, ihre Beständigkeit beruht auf der bei Zimmertemperatur hohen Aktivierungsenergie. Sie sind kinetisch inert aber thermodynamisch instabil.
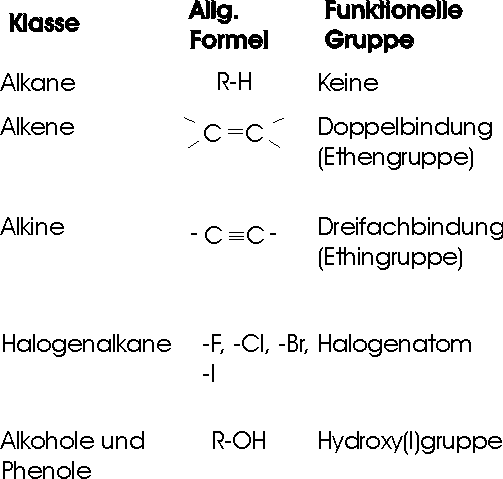
Die große Masse der organischen Verbindungen kann je nach dem Bau des Kohlenstoffgerüstes in verschiedenen Gruppen von Verbindungen eingeteilt werden:
Verbindungen mit kettenförmigen Gerüsten werden häufig aliphatisch (aleiphar gr. = Fett) genannt, weil die Fette zu dieser Gruppe gehören.
Die Verbindungen mit ringförmigen Strukturen gliedern sich in alizyklische und aromatische Verbindungen.
Alizyklische Ringe zeigen die Bindungsverhältnisse und Eigenschaften aliphatischer Verbindungen (CnH2n).
Aromatische Ringe zeigen besondere Bedingungen (Benzol; C6H6).
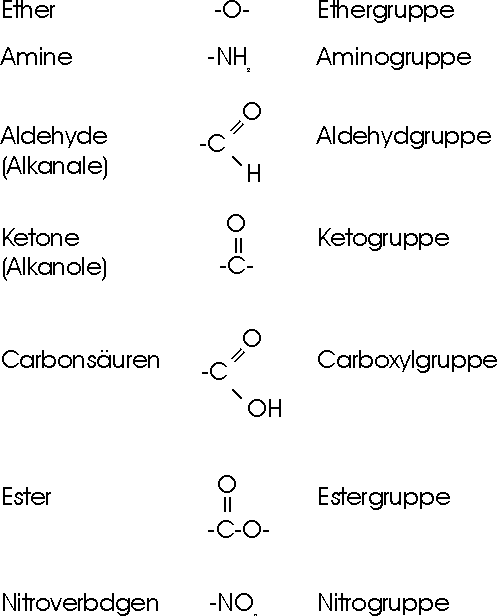
Neben den reaktionsträgen C-H und C-C Bindungen enthalten die meisten organischen Verbindungen weitere reaktionsfähige Atomgruppen, indem Fremdatome, wie Sauerstoff, Stickstoff, Schwefel u.a., mit Kohlenstoffatomen polare Bindungen bilden. Diese funktionellen Gruppen sind für das Verhalten sehr vieler Verbindungen von ganz entscheidender Bedeutung
Diese Verbindungen können von den Kohlenwasserstoffen durch den Ersatz eines/mehrer Wasserstoffatome durch ein anderes Atom oder Atomgruppen abgeleitet werden. In diesen Derivaten ist ein einbindiger Kohlenwasserstoff-Rest (durch das Symbol R gekennzeichnet) mit der funktionellen Gruppe verknüpft. Als funktionelle Gruppe wird eine Atomgruppe (oder ein Atom) bezeichnet, welche die Eigenschaften einer organischen Verbindung wesentlich bestimmt und die Struktur der Verbindungsklasse kennzeichnet