
| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
Aufgrund der starken Polarität der C=O werden die Bindungen in den benachbarten Kohlenstoffatomen stark beeinflußt, es kommt zum sogenannten negativen Induktiven Effekt der Carbonylgruppe (Elektronen werden zum Alpha-C-Atom hin verschoben). Dieses kann auf das benachbarte Kohlenstoffatom (Alpha-C-Atom) zwei unterschiedliche Auswirkungen haben. Zum Einen kann hier unter Einwirkung einer starken Base ein H-Atom abgespalten werden, was den leicht sauren Charakter der Carbonylverbindung erklärt.

Zum Anderen kann es zu einem intramolekularen Protonenübergang kommen wodurch sich ein Enol bildet.

Dieses hat eine C=C-Bindung und eine OH-Gruppe. Die elektrophile Substitution wird durch die C=O-Bindung
ebenfalls erleichtert.
Diese Umlagerung ist mit verantwortlich für die Ringbildung bei den Kohlenhydraten.
Carbonylverbindungen mit der Gruppierung CO-CH3 reagieren in der Hitze mit einer Iodlösung zu gelbem, schwer löslichen Triiodmethan (Iodoform): "Iodoformreaktion".
Gewisse Additionen werden durch Säuren katalysiert, weil das Carbonyl-O-Atom deutlich basisch ist und somit ein Proton addieren kann. Dadurch wird die positive Polarisierung des Carbonyl-C-Atoms erhöht und dessen Bereitschaft zurAddition eines Nucleophils erleichtert.


Wie erwähnt können Carbonylverbindungen unter der Wirkung starker Basen ein Proton abspalten und dabei Carbanionen bilden. Carbanionen sind sehr stark nucleophil und werden leicht an ein Carbonyl-C-Atom addiert, wodurch sich neue C-C-Bindungen bilden. Den einfachsten Fall einer solchen Reaktion stellt die Bildung von Aldol aus zwei Molekülen Acetaldehyd dar (Aldoladdition)

Insbesondere Methanal (Formaldehyd) und Ethanal (Acetaldehyd) neigen in alkalischen Lösungen zu fortgesetzter Aldoladdition: Dabei entstehen harzartige oder schmierige Polymerisationsprodukte.
Zur Bezeichnung der Aldehydgruppe dient die Endung -al: die niederen Aldehyde werden gewöhnlich nach der aus ihnen durch Oxidation entstehenden Säuren benannt: Formaldehyd (Methanal) ergibt Ameisensäure,acidum formicicum , Acetaldehyd (Ethanal) ergibt Essigsäure, acidum aceticum.
Dank der stark polaren Carbonylgruppe sind die Aldehydmoleküle permanente Dipole; ihre Siedepunkte liegen daher höher als die Siedepunkte von Kohlenwasserstoffen gleicher Kohlenstoffzahl, jedoch deutlich tiefer als bei entsprechenden Alkoholen. Aldehyde von niedriger Molekülmasse riechen unangenehm-stechend; höhere und besonders manche aromatischen Aldehyde sind jedoch durch angenehm aromatischen Geruch ausgezeichnet und kommen als Geruchsträger verschiedener ätherischer Öle oder Pflanzenteile in der Natur vor: Vanillil in Vanilleschoten, Benzaldehyd im Bittermandelöl, Anisaldehyd in Anisöl, Citral in Citronenöl, usw.
Die niederen Aldehyde sind gut wasserlöslich. Dies beruht darauf, dass die polare Doppelbindung ein Wassermolekül addiert und
die entstehenden Hydroxylgruppen mit Wassermolekülen Wasserstoffbrücken bilden können.
Die auffallendste Eigenschaft der Aldehyde ist ihre leichte Oxidierbarkeit, also ihre stark reduzierende
Wirkung.
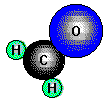 Formaldehyd, Methanal HCOH, der einfachste Aldehyd, ist ein farbloses, stechend riechendes Gas
(Sdp. -21°C), das sich in Wasser sehr gut löst. Eine 30%ige Lösung kommt als "Formalin" in den Handel.
Formaldehyd, Methanal HCOH, der einfachste Aldehyd, ist ein farbloses, stechend riechendes Gas
(Sdp. -21°C), das sich in Wasser sehr gut löst. Eine 30%ige Lösung kommt als "Formalin" in den Handel.
 Formaldehyd ist giftig und dient als Gas oder in Lösung zur Desinfektion. Eiweiß wird durch Formaldehyd gehärtet und gegerbt.
Formaldehyd polymerisiert leicht zu festem "Paraformaldehyd" (CH2O)n [n ~ 12-30].
Formaldehyd ist giftig und dient als Gas oder in Lösung zur Desinfektion. Eiweiß wird durch Formaldehyd gehärtet und gegerbt.
Formaldehyd polymerisiert leicht zu festem "Paraformaldehyd" (CH2O)n [n ~ 12-30].
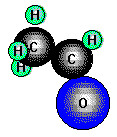 Acetaldehyd, Ethanal, Sdp. 20,2°C durch Dehydrierung von Ethylen herstellbar ist ein Zwischenprodukt
Acetaldehyd, Ethanal, Sdp. 20,2°C durch Dehydrierung von Ethylen herstellbar ist ein Zwischenprodukt
 bei der technischen Essigsäuresynthese und wird in großem Maßstab durch direkte Oxidation von Ethen
bei der technischen Essigsäuresynthese und wird in großem Maßstab durch direkte Oxidation von Ethen

oder durch Addition von Wasser an Ethin unter der katalytischen Wirkung von Quecksilbersulfat (über Vinylalkohol, der durch intramolekulare Umlagerung in das Ethanal übergeht) hergestellt:

Mit konz. Schwefelsäure als Katalysator polymerisiert Acetaldehyd beim Erhitzen zu Paraldehyd mit einem ringförmigen Molekül ("Trockenspiritus").
Ketone sind weniger reaktiv als Aldehyde; insbesondere polymerisieren sie nicht und können nicht zu Carbonsäuren gleicher Kohlenstoffzahl oxidiert werden. Dank der leichten Substituierbarkeit der Wasserstoffatome an den beiden Alpha-ständigen Kohlenstoffatomen bilden jedoch viele Ketone wichtige Zwischenprodukte bei der Synthese anderer Verbindungen.
Aceton, Propanon , das einfachste und wichtigste Keton, entsteht durch Dehydrierung von 2-Propanol
 (Isopropanol) und kann durch trockene Destillation von Kalium- oder Calciumacetat erhalten werden.
Die charakteristisch riechende Flüssigkeit (Sdp. 56,5°C) mischt sich in jedem Verhältnis mit Wasser,
ist aber gleichzeitig deutlich lipophil; Verwendungen als Lösungsmittel für Lacke, Kunstharze, Kunstseide,
Plexiglas, Klebstoff usw.
(Isopropanol) und kann durch trockene Destillation von Kalium- oder Calciumacetat erhalten werden.
Die charakteristisch riechende Flüssigkeit (Sdp. 56,5°C) mischt sich in jedem Verhältnis mit Wasser,
ist aber gleichzeitig deutlich lipophil; Verwendungen als Lösungsmittel für Lacke, Kunstharze, Kunstseide,
Plexiglas, Klebstoff usw.