| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
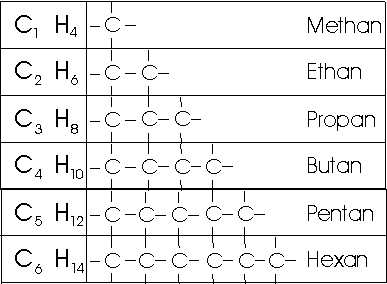
1. gesättigte Kohlenwasserstoffe (Alkane oder auch "Parafine")
2. ungesättigte Kohlenwasserstoffe (Alkene ["Olefine"] und Alkine)
3. aromatische Kohlenwasserstoffe

Beim Butan (C4H10) sind zwei verschiedene Strukturen möglich. Der Summenformel C5H12 (Pentan) entsprechen sogar drei, der Summenformel C6H14 (Hexan) fünf verschieden gebaute Verbindungen.
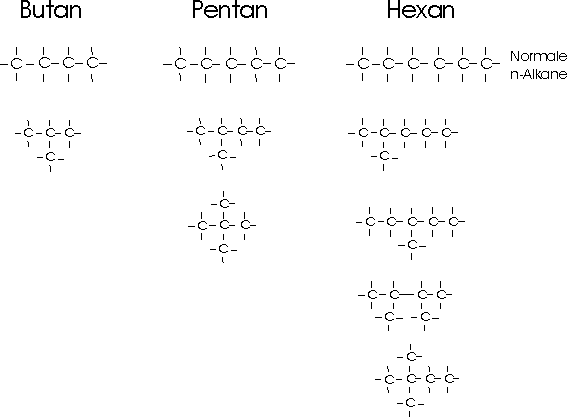
Beruht die Isomerie, wie in diesem Beispiel, auf einer unterschiedlichen Verknüpfung der Atome im Molekül,
also auf verschiedener Struktur der Moleküle, so spricht man von Strukturisomerie. Da die Variationen durch
eine Änderung im Kohlenstoffgerüst entsteht, wird sie auch als Gerüstisomerie bezeichnet.
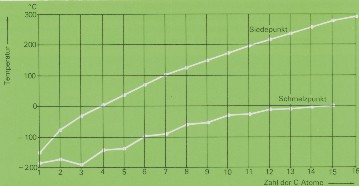
Die Isomerenzahl wächst sehr rasch mit steigender Kohlenstoffzahl.
Von C7H16 (Heptan) existieren 9, von Oktan C8H18 18, von C10H22 schon 75 Isomere. Von C15H32 sind 4347 und von C20H42 366319
Isomere möglich.
Die Zahl der wirklich dargestelten Isomere ist natürlich viel kleiner als die Zahl der
theoretisch möglichen. Die einzelnen Isomere sind sich in ihren Eigenschaften stets sehr ähnlich;
nur Schmelz- und Siedepunkt sowie Dichte hängen stärker von der Struktur der Moleküle ab und zeigen
bei verschiedenen Isomeren deutliche Unterschiede:
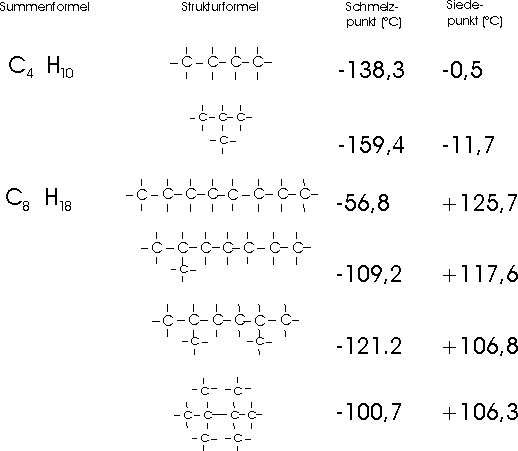
Die Genfer Nomenklatur geht von folgenden Grundsätzen aus:
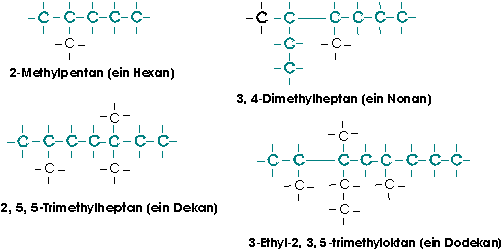
1. Für die zu benennende Verbindung sucht man die längste Kohlenstoffkette im Molekül. Entsprechend wird das Namensende gebildet: z.B. -hexan.
2. Die Seitenketten werden entsprechend der Zahl ihrer Kohlenstoffatome gebildet und mit der Endung -yl versehen: z.B. ist CH3- die Methylgruppe, C2H5- die Ethylgruppe.
3.Die Zahl der Seitengruppen wird, wenn von 1 abweichend durch die Silben Di-, Tri-, Tetra-, Penta- gekennzeichnet: z.B. bedeutet Dimethyl- : zwei Methylgruppen als Seitengruppen der Hauptkette.
4.Die Stellung der Seitengruppen wird durch arabische Ziffern angegeben, die sich aus der Numerierung der Kohlenstoffatome in der längsten Kohlenstoffkette ergeben. Die Numerierung ist so durchzuführen, dass Verzweigungen (bzw. funktionelle Gruppen) eine möglichst niedrige Nummer erhalten: so bedeutet 2-Methyl-, dass am zweiten Kohlenstoffatom der Hauptkette eine Methylgruppe sitzt, 3,4-Dimethyl-, dass an der Hauptkette insgesamt zwei Methylgruppen, und zwar am 3. und 4. Kohlenstoffatom dieser Kette sitzen.
5. Die Seitengruppen werden in alphabetischer Reihenfolge genannt (also -ethyl vor -methyl).
Nach diesen Regeln ergeben sich für folgende Alkane die rationellen Benennungen:
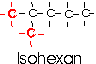 Gebräuchlich ist auch die Kennsilbe Iso- für Alkane mit zwei endständigen Methylgruppen.
Gebräuchlich ist auch die Kennsilbe Iso- für Alkane mit zwei endständigen Methylgruppen.
Von Substitution spricht man, wenn ein Atom oder eine Atomgruppe durch ein anderes Atom oder eine andere
Atomgruppe ersetzt wird.
Dabei muß im Prinziep eine Trennung sowie eine Neubildung einer Bindung erfolgen. Als Beispiel dient
die Reaktion von Hexan mit Brom:
An der Luft oder in Sauerstoff verbrennen die Kohlenwasserstoffe bei höheren Temperaturen vollständig zu Wasser und Kohlendioxid:
2 C6H14 + 19 O2 -> 12 CO2 + 14 H2O
Erhitzt man Kohlenwasserstoffe unter Ausschluß von Sauerstoff auf einige 100°C, so zersetzen sich die Moleküle (Cracken, Hitzespaltung). Dabei werden Bindungen zwischen Kohlenstoffatomen gespalten, so dass kleinere Bruchstücke der Moleküle entstehen.
Methan, ein farb- und geruchloses Gas, bildet den Hauptanteil der in vielen Gegenden gewonnenen
Erdgase.
 Es ist seit einiger Zeit zu einem außerordentlich wichtigen Rohstoff zur Gewinnung von Ausgangssubstanzen
für viele Synthesen geworden. Durch thermische Spaltung oder durch Reaktionen mit Wasserdampf
(an Nickel-Katalysatoren) wird daraus Wasserstoff gewonnen, durch Hitzespaltung gewinnt man
Acetylen (Ethin) C2H2:
Es ist seit einiger Zeit zu einem außerordentlich wichtigen Rohstoff zur Gewinnung von Ausgangssubstanzen
für viele Synthesen geworden. Durch thermische Spaltung oder durch Reaktionen mit Wasserdampf
(an Nickel-Katalysatoren) wird daraus Wasserstoff gewonnen, durch Hitzespaltung gewinnt man
Acetylen (Ethin) C2H2:
CH4 + H2O -> CO + 3 H2
(bei 800-900°C, an einem Nickelkatalysator)
2 CH4 -> C2H2 + 3 H2
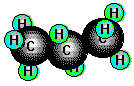
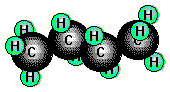 Propan und Butan
treten ebenfalls in Erdgasen, als Begleiter des Erdöls und in Crackgasen auf.
Propan und Butan
treten ebenfalls in Erdgasen, als Begleiter des Erdöls und in Crackgasen auf.
Benzin enthält vorwiegend Kohlenwasserstoffe von C7 bis C10, Petrolether (wichtiges Lösungsmittel) sowie Pentane und Hexane.
Paraffinöle sind Mischungen flüssiger Kohlenwasserstoffe mit C12 bis C16.
Paraffin besteht aus Mischungen fester Alkane (C22 bis etwa C40); Hartparaffin enthält mehr höherschmelzende, längere Ketten, Weichparaffin kürzere und mehr verzweigte Ketten.
Neben den aliphatischen Kohlenwasserstoffen mit offener, gerader oder verzweigter C-Kette existieren auch gesättigte Kohlenwasserstoffe mit ringförmigem Kohlenstoffgerüst; die Cycloalkane:
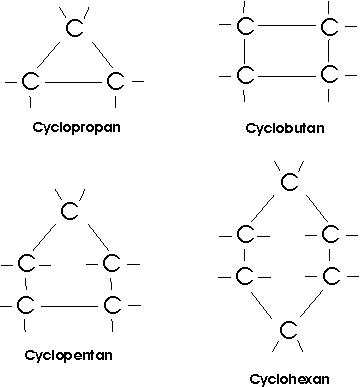
Cyclopropan (brennbares Gas, Sdp. -33°C) und Cyclobutan
 (brennbares Gas, Sdp. 12,5°C) sind
ziemlich reaktionsfähige Substanzen, weil die Winkel zwischen den Kohlenstoffatomen ziemlich stark vom
Tetraederwinkel abweichen und die Ringe daher unter einer gewissen inneren Spannung stehen.
(brennbares Gas, Sdp. 12,5°C) sind
ziemlich reaktionsfähige Substanzen, weil die Winkel zwischen den Kohlenstoffatomen ziemlich stark vom
Tetraederwinkel abweichen und die Ringe daher unter einer gewissen inneren Spannung stehen.
Cyclopentan (farblose Flüssigkeit; Sdp. 49°C) und Cyclohexan
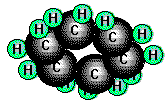 (farblose Flüssigkeit; Sdp. 81°C)
sind ebenso wie die kettenförmigen Kohlenwasserstoffverbindungen sehr beständig. Im Cyclopentan bilden die Kohlenstoffatome
einen Fünfring, der ebenso wie der Sechsring im Cyclohexan nicht eben gebaut ist. Die Kohlenstoffatome liegen bei ihnen nicht
in einer Ebene, so dass die Bindungswinkel dem Tetraederwinkel entsprechen. Ringe mit 14 bis 18 C-Atomen
sind in gewissen Riechstoffen (Moschus) enthalten.
(farblose Flüssigkeit; Sdp. 81°C)
sind ebenso wie die kettenförmigen Kohlenwasserstoffverbindungen sehr beständig. Im Cyclopentan bilden die Kohlenstoffatome
einen Fünfring, der ebenso wie der Sechsring im Cyclohexan nicht eben gebaut ist. Die Kohlenstoffatome liegen bei ihnen nicht
in einer Ebene, so dass die Bindungswinkel dem Tetraederwinkel entsprechen. Ringe mit 14 bis 18 C-Atomen
sind in gewissen Riechstoffen (Moschus) enthalten.
Viele Halogenalkane sind wichtige Zwischenprodukte für Synthesen. Man gewinnt sie durch direkte Halogenierung gesättigter Kohlenwasserstoffe oder aus Alkoholen:
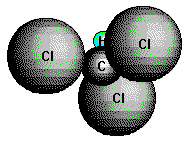 (Trichlormethan, CHCl3),
eine süßlich riechende, schwere Flüssigkeit (Narkotikum), Iodoform (CHI3), eine gelbliche,
charakteristisch riechende Substanz, die zu Desinfektionszwecken verwendet wird, und Tetrachlorkohlenstoff
(Tetrachlormethan, CCl4),
(Trichlormethan, CHCl3),
eine süßlich riechende, schwere Flüssigkeit (Narkotikum), Iodoform (CHI3), eine gelbliche,
charakteristisch riechende Substanz, die zu Desinfektionszwecken verwendet wird, und Tetrachlorkohlenstoff
(Tetrachlormethan, CCl4),
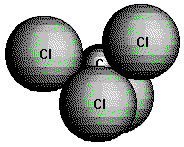 eine nicht brennbare Verbindung von süßlichem Geruch (Lösungsmittel,
Feuerlöschmittel).
eine nicht brennbare Verbindung von süßlichem Geruch (Lösungsmittel,
Feuerlöschmittel).
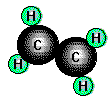
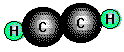 sondern weisen die Formel CnH2n oder CnHn auf.
Beispiele sind das Ethen
(Ethylen) mit der Formel C2H4 und das Ethin (Acetylen), C2H2.
sondern weisen die Formel CnH2n oder CnHn auf.
Beispiele sind das Ethen
(Ethylen) mit der Formel C2H4 und das Ethin (Acetylen), C2H2.
Nach der Genfer Nomenklatur werden Kohlenwasserstoffe mit Doppelbindungen durch die Endsilbe -en charakterisiert. Die Endung -in wird für Dreifachbindungen verwendet. Die Lage der Mehrfachbindungen im Molekül wird durch die Nummer des Kohlenstoffatoms bezeichnet, das in der Mehrfachbindung die kleinere Nummer trägt:
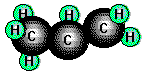 CH3-CH=CH2 (Propen)
CH3-CH=CH2 (Propen)
CH3-CH2-CH2-CH=CH2 (1-Penten)
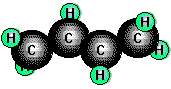
CH2=CH-CH=CH2 (1, 3 -Butadien)
Der Name verzweigter Alkene bzw. Alkine wird von dem unverzweigten Kohlenwasserstoff abgeleitet, der die maximale Zahl der Mehrfachbindungen enthält. Die Kette wird dann so numeriert, dass die Doppel- (bzw. Dreifach-) Bindung die niedrigste Ziffer erhält:
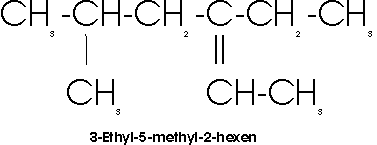
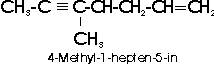

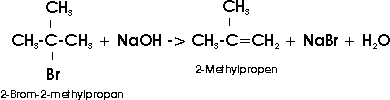
Das charakteristische Merkmal ungesättigter Kohlenwasserstoffe ist ihre Fähigkeit zur Addition
anderer Substanzen: Halogene, Halogenwasserstoffe, Säuren, Wasser usw..
So können Ethylalkohol durch katalytische Wasseranlagerung an Ethen
 (z.B Vinylchlorid) durch Addition von Halogenwasserstoffen an
Alkinen hergestellt werden.
(z.B Vinylchlorid) durch Addition von Halogenwasserstoffen an
Alkinen hergestellt werden.
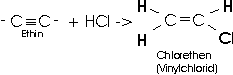
Durch Hydrierung der Doppelbindung (d.h. katalytische Addition von Wasserstoff) entstehen Alkane.
Eine besonders wichtige Additionsreaktion ungesättigter Verbindungen ist die Polymerisation, d.h. die Anlagerung anderer ungesättigter Moleküle an die Doppelbindung, so dass hochmolekulare Ketten entstehen. So entsteht durch Polymerisation von Ethen der Kunststoff Polyethylen; durch Polymerisation von Chlorethen (Vinylchlorid) das Polyvenylchlorid (PVC).
 Ausgangsstoffe für die Synthese zahlreicher Großprodukte (Ethin, Ethylalkohol, Styrol, Kunststoffe).
Man gewinnt es heute hauptsächlich durch thermische Spaltung von Leichtbenzin oder Rohöl oder
durch Dehydrierung des in gewissen Erdgasen enthaltenen Ethans.
Ausgangsstoffe für die Synthese zahlreicher Großprodukte (Ethin, Ethylalkohol, Styrol, Kunststoffe).
Man gewinnt es heute hauptsächlich durch thermische Spaltung von Leichtbenzin oder Rohöl oder
durch Dehydrierung des in gewissen Erdgasen enthaltenen Ethans.
Propen, (Propylen, CH3-CH=CH2),
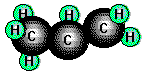 das ebenfalls bei der Aufarbeitung des Erdöls anfällt, ist bedeutsamer
Ausgangsstoff für die Synthese von Kunststoffen und Kunstfasern.
das ebenfalls bei der Aufarbeitung des Erdöls anfällt, ist bedeutsamer
Ausgangsstoff für die Synthese von Kunststoffen und Kunstfasern.
Butadien (1,3-Butadien) CH2=CH-CH=CH2
 und Chlorbutadien
(2-Chlor-1,3-butadien CH2=CCl-CH=CH2) dienen als Ausgangsstoffe zur Gewinnung von künstlichem Kautschuk.
Beide Moleküle besitzen konjugierte Doppelbindungen, wobei Einfach- und Doppelbindung regelmäßig
abwechseln. Doppelbindungen können auch kumuliert (gehäuft, z.B. im CH2=C=CH2) oder
isoliert (durch zumindest zwei Einfachbindungen getrennt) auftreten.
und Chlorbutadien
(2-Chlor-1,3-butadien CH2=CCl-CH=CH2) dienen als Ausgangsstoffe zur Gewinnung von künstlichem Kautschuk.
Beide Moleküle besitzen konjugierte Doppelbindungen, wobei Einfach- und Doppelbindung regelmäßig
abwechseln. Doppelbindungen können auch kumuliert (gehäuft, z.B. im CH2=C=CH2) oder
isoliert (durch zumindest zwei Einfachbindungen getrennt) auftreten.
Ethin (Acetylen), CH///CH, ist der wichtigste Kohlenwasserstoff mit einer Dreifachbindung
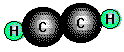 und wichtiger Ausgangsstoff für Synthesen. Es ist ein farbloses, in reinem Zustand nicht unangenehm
riechendes Gas, das beim Erhitzen unter starker Wärmeabgabe in seine Elemente zerfällt:
und wichtiger Ausgangsstoff für Synthesen. Es ist ein farbloses, in reinem Zustand nicht unangenehm
riechendes Gas, das beim Erhitzen unter starker Wärmeabgabe in seine Elemente zerfällt:
C2H2 -> 2C + H2
Bei geringer Druckerhöhung tritt der Zerfall explosionsartig schon bei Zimmertemperatur ein.
Die Verbrennung liefert sehr viel Wärme. Mischungen mit Luft, die zwischen 3% und 70% Ethin enthalten,
können heftig explodieren. Verbrennt man Ethin in besonders konstruierten Brennern, so erhält man trotz
des relativ hohen Kohlenstoffgehaltes eine nur wenig rußende Flamme; die abgeschiedenen Kohlenstoffkörnchen
glühen vielmehr bei der hohen Flammentemperatur hell auf und verbrennen zum größten Teil. Die hohe
Verbrennungswärme wird beim autogenen Schweißen und Schneiden ausgenützt; Verbrennung im
Gemisch mit Sauerstoff ergibt Flammentemperaturen bis 3100°C. Beim Schneiden wird zuerst eine Stelle
zur Weißglut erhitzt, dann die Ethinzufuhr abgestellt; der Sauerstoff verbrennt das Eisen zu Oxid
und bläst diesen weg.
Ethin hat ganz schwach sauren Charakter. Lange Zeit wurde Ethin nahezu ausschließlich aus Calciumcarbid (im Lichtbogen aus Koks und gebranntem Kalk hergestellt) durch Umsetzung mit Wasser gewonnen:
CaC2 + 2 H2O -> C2H2 + Ca(OH)2
Heute erhält man die Hauptmenge des Ethins aus Erdgasen und Erdöl durch
1. thermische Umwandlung von Methan im elektrischen Lichtbogen
2 CH4 -> C2H2 + 3 H2 (bei 1400°C)
2. partielle Oxidation von Methan:
4 CH4 + O2 -> C2H2 + 2 CO2 + 7 H2
3. Dehydrierung von Ethen:
C2H4 -> C2H2 + H2
Allmählich erkannte man aber, dass alle aromatischen Verbindungen einen "Kern" von sechs Kohlenstoffatomen
enthalten, der auch im Benzol enthalten ist.
Da der Benzolkern gewisse charakteristische Eigenschaften zeigt, wurden in der Folgezeit alle Stoffe, die sich vom Benzol ableiten
"aromatisch" genannt, ungeachtet, ob sie einen besonderen Geruch besitzen, natürlich vorkommende oder synthetische
Stoffe sind.
Benzol, der Grundkörper der meisten aromatischen Verbindungen, ist eine farblose leichtbewegliche
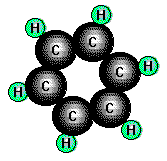 Flüssigkeit (Smp. 5,5°C, Sdp. 80,1°C) von charakteristischem Geruch. Die gute Löslichkeit von Fetten, Harzen
und Kohlenwasserstoffen in Benzol weist auf eine unpolare Struktur der Benzolmoleküle hin.
Flüssigkeit (Smp. 5,5°C, Sdp. 80,1°C) von charakteristischem Geruch. Die gute Löslichkeit von Fetten, Harzen
und Kohlenwasserstoffen in Benzol weist auf eine unpolare Struktur der Benzolmoleküle hin.
Bei einem Atomzahlenverhältniss C:H von 1:1 und einer molaren Masse von 78g/mol ergibt sich die Summenformel C6H6.
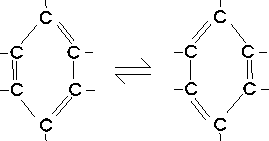
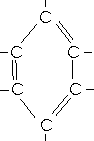 Da die Vierbindigkeit des Kohlenstoffatoms eingehalten werden muß, kann eine abwechselnde Einfach-
und Doppelbindung angenommen werden.
Da die Vierbindigkeit des Kohlenstoffatoms eingehalten werden muß, kann eine abwechselnde Einfach-
und Doppelbindung angenommen werden.
Eine zutreffende Beschreibung ist mit Hilfe einer Lewis-Strukturformel nicht möglich. Die Benzolstruktur ist vielmehr durch das Auftreten von delokalisierten Elektronen gekennzeichnet. Man kann den wirklichen Zustand formal so veranschaulichen, dass man ihn als einen Zwischenzustand zwischen real nicht existierenden "Grenzformeln" auffaßt.