| Bio-Ecke | Chemie-Ecke | Home | Unterricht | Waldbaden |
|---|
Das Hauptanliegen ist jedoch die chemische Reaktion. Unter welchen Bedingungen laufen Stoffumwandlungen ab, wie schnell erfolgen sie, wie fördert man erwünschte Reaktionen und wie verhindert man unerwünschte, welche Energieumsetzungen erfolgen, welche Stoffmengen werden umgesetzt und insbesondere wie kann man natürliche oder künstliche Stoffe herstellen. Zusammenfassend kann man sagen Chemie ist die Wissenschaft, die sich mit der Charakterisierung, Zusammensetzung und Umwandlung von Stoffen befaßt.
Handwerkskünste (bis 600 vor Christus). Erzeugung von Metallen aus Erzen, Töpferei, Brauerei, Backen, Farben, Heilmittelherstellung wurde bereits von den alten Ägyptern genutzt ohne das sie wußten wie und warum es funktionierte.
Griechische Theorie (600 bis 300 v. Chr.). Die griechischen Philosophen suchten
bereits nach Prinzipien, mit denen sich die Natur verstehen läßt. Zwei griechische
Theorien beeinflußten das Denken noch viele Jahrhunderte lang.
1. Die Vorstellung, alle Stoffe seien aus den vier Elemente Erde, Feuer, Wasser,
Luft aufgebaut.
2. Die Theorie, das alle Stoffe aus definierten kleinsten Teilchen, den Atomen
bestehen.
Alchemie (300 v. Chr. bis 1650 n. Chr.). Aus der griechischen Theorie und den alten
Handwerkskünsten erwuchs in Alexandrien die Alchemie. Ein vorrangiges Interesse
der Alchemisten war die Stoffumwandlung von unedlen Metallen in Gold. Sie
glaubten an die Existenz eines geheimnisvollen Umwandlungsmittel, später Stein
der Weisen genannt, das in kleinsten Mengen die Veränderung in Gang setzen
könnte.
Die Araber nannten den Stein der Weisen El-Iksir aus dem später das Wort Elixier
hervorging.
In ihrem vergeblichen Bemühen, billiges Blei in teures Gold zu verwandeln, haben die mittelaterlichen Alchemisten einen Großteil jener Techniken und Verfahren entwickelt, die noch heute den Laboralltag des Chemikers bestimmen. Auch wenn es diesen Pionieren der Chemie nie gelungen ist, die beiden Metalle ineinander umzuwandeln (das passiert nur in den Sonnen), haben ihre Fehlschläge doch der modernen Chemie den Weg geebnet. Zahlreiche chemische Prozesse, etwa die Herstellung von Säuren aus Mineralien und die von Seife aus Fetten, gehen auf die Alchemisten zurück.
Moderne Chemie (seit 1790). Antoine Lavoisier wird als erster Chemiker angesehen, er benutzte als erster eine Waage um chemische Erscheinungen zu erklären. Er formulierte als erster das Gesetz der Erhaltung der Massen, welches besagt, das während einer chemischen Reaktion weder ein Verlust noch ein Gewinn an Masse (Gewicht) zu beobachten ist. (1. Grundgesetz der Chemie)
Im Laufe der Zeit hat sich die Chemie in verschiedene Fachgebiete verzweigt. Organische Chemie, Anorganische Chemie, Analytische Chemie, Physikalische Chemie, Biochemie, Kernchemie, u.a..
Zur Zeit sind ca. 112 Elemente bekannt. Jedes Element hat einen Namen und ein
chemisches Symbol, dieses Symbol besteht aus einem oder zwei Buchstaben (bei
neueren Elementen auch drei).
Die 15 häufigsten Elemente im Bereich der Erdkruste, Ozeane und Atmosphäre sind
in der Tabelle aufgeführt.
| Rang | Element | Symbol | Massenanteil(%) |
|---|---|---|---|
| 1 | Sauerstoff | ||
| 2 | Silicium | ||
| 3 | Aluminium | ||
| 4 | Eisen | ||
| 5 | Calcium | ||
| 6 | Natrium | ||
| 7 | Kalium | ||
| 8 | Magnesium | ||
| 9 | Wasserstoff | ||
| 10 | Titan | ||
| 11 | Chlor | ||
| 12 | Phosphor | ||
| 13 | Mangan | ||
| 14 | Kohlenstoff | ||
| 15 | Schwefel |
Würde man das Erdinnere mit berücksichtigen wäre Eisen (Fe) das häufigste Element. Das häufigste Element im ganzen Universum ist Wasserstoff (H).
Verbindungen sind Stoffe, die aus verschiedenen Elementen in ständig gleicher Art
und Weise zusammengesetzt sind. Nach dem Gesetz der konstanten Proportionen
besteht eine Verbindung immer aus den gleichen Elementen im gleichen
Massenverhältniss. (2. Grundgesetz der Chemie)
So besteht Wasser aus den Elementen Sauerstoff (O) und Wasserstoff (H) im
Massenverhältniss 11,19% Wasserstoff zu 88,81% Sauerstoff. ( Hier auf der Erde
kann man sagen, daß von 100g Wasser 11,19g Wasserstoff und 88,81g Sauerstoff
ausmachen.)
Verbindungen haben andere Eigenschaften als die Elemente aus denen sie
bestehen. Man kennt über 12 000 anorganische und über 4 000 000 organische
Verbindungen.
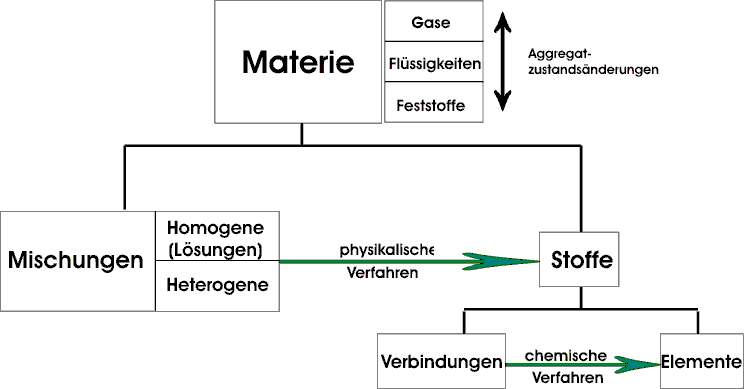
Sowohl Elemente wie auch Verbindungen sind reine Stoffe. Alle anderen Stoffe sind Gemische. Gemische bestehen aus mehreren reinen Stoffen in wechselndem Mengenverhältnis. Man unterscheidet zwei Sorten von Gemischen, ein heterogenes (unterschiedliches) Gemisch und ein homogenes (einheitliches) Gemisch.

Ein heterogenes Gemisch besteht erkennbar aus unterschiedlichen Teilen, zum
Beispiel Sand + Eisenpulver. Ein homogenes Gemisch erscheint durch und durch
einheitlich, zum Beispiel Luft.
Heterogene Gemische bestehen aus mehreren einheitlichen Phasen mit
erkennbaren Grenzflächen (Phasengrenzen) z.B.: Granit.
Diese verschiedenen Aggregatzustände unterscheiden die Einteilung eines heterogenen Gemisches.
| Aggregatzustand der Phasen | Bezeichnung | Beispiele | Verfahren zur Trennung |
|---|---|---|---|
| fest + fest | Gemenge | Granit,Sand,Salz | Sortieren,Sieben Extrahieren |
| fest + flüssig | Suspension | Schlamm Malerfarbe | Zentrifugieren Filtrieren |
| flüssig + flüssig | Emulsion | Milch | Zentrifugieren Scheidetrichter |
| fest + gasförmig | Aerosol | Rauch | elektrostatische Trennung, Filter |
| flüssig + gasförmig | Aerosol | Nebel, Schaum | Sedimentieren |
Physiker kennen insgesamt fünf Aggregatzustände; zu fest, flüssig und gasförmig kommen noch das Plasma, welches bei extrem hoher Temperatur und Druck existiert (z.B. in der Sonne), und das Einstein-Bose-Kondensat . Bei einem Bose-Einstein-Kondensat (BEC) handelt es sich um einen neuen Materiezustand, bei dem die Atome gemeinsam den niedrigst möglichen Energiezustand einnehmen. Sie müssen dazu bis extrem dicht an den absoluten Nullpunkt von 0 Kelvin abgekühlt werden. Der Prozess erinnert an die Kondensation von Flüssigkeitstropfen aus einem Gas. Daher wird von einem Bose-Einstein-Kondensat gesprochen. In solchen Kondensaten geben die Atome ihre Eigenständigkeit auf und vereinigen sich zu einer Art "Superatom". Im Rahmen der Heisenbergschen Unschärferelation nehmen sie denselben Ort ein und besitzen dieselbe Geschwindigkeit und Energie. Ihre quantenphysikalischen Wellenfunktionen verschmelzen zu einer einzigen, die sich über das ganze Kondensat erstreckt. Die Existenz eines solchen Materiezustands wurde bereits 1924 von Albert Einstein vorhergesagt. Er hatte die Berechnungen des indischen Physikers Satyendra Nath Bose über Lichtpartikel auf Atome erweitert und postuliert, dass sie bei extrem niedrigen Temperaturen einen gemeinsamen Energiezustand einnehmen.
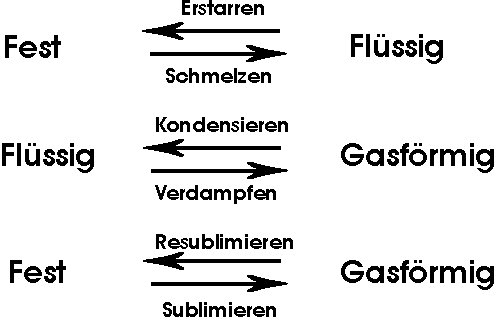 Der Übergang von einer Flüssigkeit zu einem Feststoff wird als Erstarren oder (z.B. bei Wasser) als Gefrieren bezeichnet. Man kann feststellen, dass die Veränderungen bei jeweils stoffspezifischen Temperaturen auftreten. Diese Temperaturen gehören zu den physikalischen Eigenschaften der betreffenden Substanz. Erhitzt man einen Stoff, beispielsweise Eis, so bleibt er so lange fest, bis seine Temperatur den Schmelzpunkt erreicht hat. Dann beginnt der Körper sich nach und nach zu verflüssigen. Während dieser Umwandlung bleibt die Temperatur des schmelzenden Eises konstant, auch wenn man weiter Wärme zuführt. Erst wenn das gesamte Eis zu flüssigem Wasser geworden ist, steigt die Temperatur wieder an.
Der Übergang von einer Flüssigkeit zu einem Feststoff wird als Erstarren oder (z.B. bei Wasser) als Gefrieren bezeichnet. Man kann feststellen, dass die Veränderungen bei jeweils stoffspezifischen Temperaturen auftreten. Diese Temperaturen gehören zu den physikalischen Eigenschaften der betreffenden Substanz. Erhitzt man einen Stoff, beispielsweise Eis, so bleibt er so lange fest, bis seine Temperatur den Schmelzpunkt erreicht hat. Dann beginnt der Körper sich nach und nach zu verflüssigen. Während dieser Umwandlung bleibt die Temperatur des schmelzenden Eises konstant, auch wenn man weiter Wärme zuführt. Erst wenn das gesamte Eis zu flüssigem Wasser geworden ist, steigt die Temperatur wieder an.
Eine andere Aggregatzustandsänderung tritt auf, wenn eine Flüssigkeit bis auf ihre Siedepunkt erhitzt wird. Der dann auftretende Übergang von flüssig nach gasförmig wird als Verdampfen bezeichnet. Bei den üblichen Alltagsbedingungen ("Meereshöhe") beginnt Wasser bei 100°C zu sieden. Dann bilden sich plötzlich Dampfblasen im Inneren der Flüssigkeit. Genau wie beim Schmelzen eines Feststoffes und beim Erstarren einer Flüssigkeit, bleibt auch beim kochendem Wasser die Temperatur solange konstant, bis die gesamte Flüssigkeit verdampft ist. In einem Kochtopf kann es nicht heißer als 100°C werden, solange noch Wasser in ihm enthalten ist.
Stoffe die unterhalb von 100°C sieden, bezeichnet man als flüchtig. Alkohol (Ethanol) siedet bei 78°C, ist also leichter flüchtig als Wasser. In diesem Sinne sind auch alle Gase leicht flüchtige Stoffe. Sie sind unter normalen Bedingungen gasförmig, weil ihre Siedepunkte unterhalb der Raumtemperatur liegen.
Die unterschiedlichen Schmelz- und Siedepunkte der Stoffe kann man zu ihrer Unterscheidung heranziehen. Hat man beispielsweise zwei weiße, äußerlich kaum zu unterscheidende Pulver vor sich, scheint deren Identifizierung zunächst schwierig. Ist aber eine der Substanzen bekannt und kennen wir ihren Schmelzpunkt, läßt sich nun die Unterscheidung zwischen dem Bekannten und dem Unbekannten treffen, wenn ihre Schmelzpunkte nicht zu nahe beieinanderliegen.
Eine Zustandsänderung kennen wir kaum aus dem Alltag: die Sublimation bzw. die Resublimation. Unter Sublimation versteht man den direkten Übergang eines Feststoffes in ein Gas. Ein sehr leicht sublimierender Stoff ist festes Kohlendioxid. Der Eigenschaft, direkt vom festen in den gasförmigen Zustand überzugehen, ohne zuvor flüssig zu werden, verdankt es seinen Trivialnamen "Trockeneis". Bei der Sublimation wird der flüssige Zustand, der normalerweise zwischen fest und gasförmig liegt, quasi übersprungen. Auch wenn an einem kalten, trockenen Morgen der in der Nacht gebildete Rauhreif - ohne erst zu schmelzen - in Wasserdampf übergeht, handelt es sich um eine Sublimation.
In der Regel gibt es viele Reaktionswege, über die chemische Umwandlungen erfolgen können und theoretisch könnte man alles in alles umwandeln, aber man kann nicht immer alle Bedingungen schaffen, die jede Reaktion möglich machen würde.
Sedimentieren und Dekantieren: Suspensionen werden aufgrund der Schwerkraft voneinander getrennt.
Zentrifugieren: schnelles Abtrennen von suspendierten Feststoffen, aufgrund der Zentrifugalkraft.
Filtrieren: Abtrennen fester Stoffe von Flüßigkeiten.
Extraktion: Ist von einem Gemenge der eine Stoff in einer Flüßigkeit löslich und der andere nicht, so kann der lösliche Teil mit Hilfe einer Flüßigkeit abgetrennt werden. Nach Abdampfen der Flüßigkeit (Lösungsmittel) kann der lösliche Stoff zurückgewonnen werden. z.B.: Salz und Steine, Lösungsmittel: Wasser.
Abdampfen, Trocknen: Ist eine Phase leichter verdampfbar, so kann sie durch Erhitzen entfernt werden.
Extraktion: Ein gelöster Stoff kann aus einer flüssigen Lösung entfernt werden, indem man sie mit einer anderen, mit ihr nicht mischbaren Flüssigkeit (z.B.: Oel + Wasser) durchschüttelt. Wenn der gelöste Stoff in der zweiten Flüssigkeit gut löslich ist, wird er zum Teil in diese übergehen. Durch mehrfaches Wiederholen des Vorganges kann fast der gesamte gelöste Stoff „ausgeschüttelt" werden.
Kristallisation: Gelöste, in reinem Zustand feste Stoffe können durch Kristallisation aus einer Lösung ausgeschieden werden. Hierzu muß die Löslichkeit vermindert werden, z.B.: durch Abkühlen.
Destillation: Wenn die Komponenten der Lösung unterschiedliche Siedepunkte haben, so läßt sich diejenige mit dem niedrigeren Siedepunkt leichter Verdampfen und somit Abtrennen. (Beispiel: Alkohol-Destillation)
Chromatographie: Bringt man eine flüssige Lösung mit einem festen, darin unlöslichen, möglichst porösen Stoff in Kontakt, so bleiben an der Grenzfläche fest/flüssig die Bestandteile der Lösung in dünner Schicht an der Feststoffoberfläche haften (Adsorption). Da unterschiedliche Verbindungen unterschiedlich fest haften kann man diesen Effekt zur Trennung ausnutzen. Der Feststoff wird stationäre Phase genannt. Die Lösung heißt mobile Phase, weil sie durch die stationäre Phase durchfließen muß. Während sie das tut, bleiben die in ihr gelösten Stoffe an der stationären Phase mehr oder weniger stark haften und werden dadurch zurückgehalten (Retention).
| zu messende Grösse | Einheit | Symbol |
|---|---|---|
| Basiseinheit | ||
| Länge | ||
| Masse | ||
| Zeit | ||
| Elektrischer Strom | ||
| Temperatur | ||
| Stoffmenge |
1 Kilogramm = Masse des "Urkilogramms", einem Platin-Iridium-Zylinder.
1 Sekunde = 9 192 631 770mal die Dauer einer Schwingung der Strahlung die ein Cs-Atom nach Anregung aussendet.
1 Ampere = Stromstärke, die zwischen zwei im Vakuum im Abstand von einem Meter verlaufenden elektrischen Leitern pro Meter Leiterlänge eine Kraft von 2*10-7 Newton hervorruft.
1 Kelvin = 1/273,16mal die absolute Temperatur des Tripelpunktes von Wasser.
1 Mol = Stoffmenge, die aus genauso vielen Teilchen besteht, wie in zwölf Gramm des Kohlenstoff-Atomes C enthalten sind.
Präfixe von Vielfachen
| Vorsilbe | Abkürzung | Potenz |
|---|---|---|
| exa | E | 1018 |
| peta | P | 1015 |
| tera | T | 1012 |
| giga | G | 109 |
| mega | M | 106 |
| kilo | k | 103 |
| hecto | h | 102 |
| deci | d | 10-1 |
| centi | c | 10-2 |
| milli | m | 10-3 |
| micro | µ | 10-6 |
| nano | n | 10-9 |
| pico | p | 10-12 |
| femto | f | 10-15 |
| atto | a | 10-18 |
Einheiten ohne eigenen Namen
| zu messende Grösse | Einheit |
|---|---|
| Fläche | m2 |
| Volumen | m3 |
| Dichte | g*cm-3 |
| Geschwindigkeit | m/s |
| Beschleunigung | m/s2 |
| Stoffmengenkonzentration | mol/liter |
Einheiten mit eigenem Namen
| zu messende Grösse | Einheit | Symbol |
|---|---|---|
| Kraft | Newton = kg*m/s2 | N |
| Energie | Joule = N*m | J |
| Leistung | Watt = J*s-1 | W |
| Druck | Pascal = N*m-2 | Pa |
| elektrische Ladung | Coulomb = A*s | C |
| Spannung | Volt = W/A | V |
| elektr. Widerstand | Ohm = V/A | Ohm |
| Frequenz | Hertz = 1/s | Hz |
| Bio-Ecke | Chemie-Ecke | Home | Unterricht |
|---|