| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
2 H2 + O2 --> 2 H2O
Diese Gleichung sagt aus, das zwei Moleküle H2 und ein Molekül O2 miteinander reagieren, wobei zwei Moleküle Wasser entstehen. Die Zahlen vor den Formeln werden Koeffizienten genannt und zeigen die Anzahl der beteiligten Moleküle. Nehmen wir nun nicht nur ein oder zwei Moleküle sondern ein oder zwei mal 6,02205*1023 Moleküle, dann entspricht dieses genau einem oder zwei Mol. D.h. also, das zwei Mol H2 und ein Mol O2 miteinander zu zwei Mol H2O reagieren. Die Reaktionsgleichung sagt somit aus, welche Stoffmengen in Mol umgesetzt werden.
Um das Gesetz der Erhaltung der Massen zu erfüllen, muß die Zahl der Mole auf beiden Seiten der Gleichung miteinander übereinstimmen. Die Gleichung ist ausgeglichen wenn die Molzahlen der beteiligten Elemente auf beiden Seiten übereinstimmen.
Um eine Gleichung korrekt zu formulieren, geht man in zwei Schritten vor:
1. Schritt : CS2 + Cl2 --> CCl4 + S2Cl2
2. Schritt : CS2 + 3 Cl2 --> CCl4 + S2Cl2
Tip: Wenn eine Verbindung mit Kontakt an Luft (O2) vollständig verbrennt, entstehen
häufig folgende Verbindungen, wenn die verbrannte Substanz die genannten
Elemente enthielt.
Kohlenstoff --> CO2
Wasserstoff --> H2O
Schwefel --> SO2
Stickstoff --> NOx
Oft entsprechen die zur Verfügung stehenden Mengen der Reaktionspartner nicht den Mengen, die nach der Reaktionsgleichung erforderlich sind. Wieviel H2O bekommt man aus 2 mol H2 und 2 mol O2; laut Reaktionsgleichung (s.o.) benötigen wir nur 1 mol O2 für 2 mol H2. Also kann 1 mol O2 nicht verbraucht werden. Die Reaktion kommt zum Stillstand wenn alles H2 verbraucht ist.
Um Rohstoffe zu sparen versuchen die Chemiker ihre Startbedingungen einer Reaktion so einzustellen, das keine Stoffe übrig bleiben.
Einfache Gleichungen können nach folgendem System aufgestellt werden:
Schwierigere Gleichungen können anhand der Oxidationszahlen erstellt werden.
Oft hat man verdünnte Lösungen aus konzentrierteren Lösungen herzustellen. Die Stoffmenge n eines gelösten Stoffes in einer Lösung der Konzentration c1 und dem Volumen V1 ist:
Wird die Lösung verdünnt, so vergrößert sich ihr Volumen auf den neuen Wert V2, die darin gelöste Stoffmenge n bleibt allerdings unverändert.
hieraus folgt:
Mischen wir 20ml einer 0,1 molaren HCl-Lösung mit 10 ml Wasser, ergibt sich:
0,1 * 20 = x * 30 ⇒ x = 0,1 * 20 / 30 ⇒ x = ≈ 0,0666
Die neu eingestellte HCl-Lösung ist somit 0,067 molar.
Da Wasser keine zusätzliche Konzentration mitbringt, ist diese Rechnung recht einfach.
Schwieriger wird es, wenn aus zwei unterschiedlichen Konzentrationen eine neue Konzentration eingestellt werden soll. (Natürlich kann die neue Konzentration nur zwischen den beiden anderen liegen.)
Beispielhaft kann man die Einstellung einer 75%igen Ethanol-Lösung aus einer 80%igen und einer 60%igen betrachten. Die Menge soll 200 Liter betragen.
Nehmen wir zuerst den 60%igen Alkohol:
Entsprechend der Formel c1*V1 erhält diese Lösung den Term 60/100 * x Liter. (Noch weiß man nicht wieviel Liter gebraucht werden).
der 80%ige:
erhält entsprechend den Term 80/100 * y Liter. Wir wissen aber das y Liter genau so groß sein muß wie 200 Liter minus der x Liter des 60%igen Alkohols (y=200-x). Also können wir den Term 80/100 * (200-x) aufstellen.
der 75%ige:
von dem wissen wir auch das Volumen; es soll 200 Liter ergeben ⇒ 75/100 * 200 heißt der dazu gehörende Term.
Aus den drei einzelnen Termen basteln wir jetzt einen Gemeinsamen:
(60/100 * x) + (80/100 * (200-x)) = 75/100 * 200
⇔ 60x + 80(200-x) = 75 * 200
⇔ 60x + 16000 - 80x = 15000
⇔ -20x = -1000
⇔ x = 50
Wir benötigen also 50 Liter von dem 60%igen Alkohol und (200 - 50 = 150) 150 Liter von dem 80%igen.
Anstelle der Prozent kann hier natürlich auch mit Mol Angaben gerechnet werden.
oder viel einfacher:
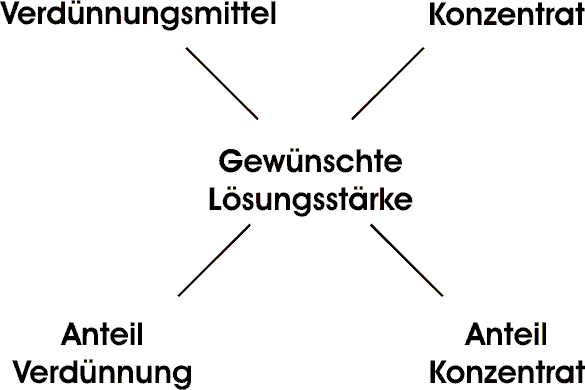
Wenn man 200 l 75%igen Spiritus aus 60 prozentigem und 80 prozentigem Spiritus mischen soll, entsprechen die 80% dem Konzentrat die 60% dem Verdünnungsmittel (Verdünnungsmittel Wasser = 0%). Die 75% entsprechen der gewünschten Lösungsstärke.
Um den Anteil des Konzentrates zu berechnen benutzt man die absoluten Differenzen zwischen Verdünnungsmittel und gewünschter Lösungsstärke (|60-75|=15).
Für den Anteil der Verdünnung, die absoluten Differenzen zwischen Konzentrat und gewünschter Lösungsstärke (|80-75|=5). ("über Kreuz rechnen")
Man braucht also 15 Teile von dem 80%igen Spiritus und 5 Teile von dem 60%igem. Da 200 Liter benötigt werden entspricht 1 Teil 10 Litern (5+15=20; 200:20=10).
Insgesamt werden also 50 Liter 60%iger und 150 Liter 80%iger Spiritus gebraucht, um daraus 200 Liter 75%igen zu mischen.
(Das funktioniert auch mit Mol.)
1. gleiche aus:
Al + HCl --> AlCl3 + H2
Cu2S + Cu2O --> Cu + SO2
WC + O2 --> WO3 + CO2
NH3 + O2 --> N2 + H2O
2. Bilde die zugehörige Formel:
a.) Bei der Verbrennung von Ethan C2H6 entstehen H2O und CO2.
b.) Wird Wasserdampf (H2O) über heißes Eisen geleitet, entsteht Wasserstoff (H2) und das Eisenoxid Fe3O4.
3. Welche Stoffmengenkonzentration hat folgende Lösung?
a.) 4g NaOH in 250 ml Lösung.
b.) 20g NaOH in 2 Liter Lösung.
4. Wie erhält man aus einer 15%-igen NaOH-Lösung 20 ml einer 8%-ige?