| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|

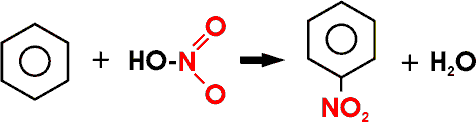
Man verwendet bei der Nitrierung die Salpetersäure meist im Gemisch mit konzentrierter Schwefelsäure; aus der Salpetersäure entsteht in dieser Lösung das Nitryl-Ion (NO2+), welches das eigentliche substituierend wirkende Teilchen ist.
Manche aliphatische Kohlenwasserstoffe können ebenfalls nitriert werden (bei 450 bis 500°C mit Salpetersäuredampf), wobei die Reaktion wahrscheinlich ähnlich wie bei der Substitution durch Brom über kurzlebige Radikale führt.
Obwohl die Nitrogruppe durch Mesomerie stabilisiert wird, sind manche Verbindungen mit mehreren Nitrogruppen im Molekül wenig stabil und neigen zu explosionsartiger Zersetzung (hoher Sauerstoffgehalt; geringe Polarität der N-O-Bindung; beim Zerfall Bildung des sehr stabilen Stickstoffmoleküls mit ganz besonders hoher Bindungsenergie). Eine Reihe von Nitroverbindungen wird deshalb als Sprengstoffe verwendet. Wegen der verhältnismäßig leichten Reduzierbarkeit der -NO2 zur -NH2-Gruppe besitzen viele Nitroverbindungen eine große Bedeutung als Zwischenprodukt für Synthesen.
Beispiele:
Nitrobenzol, C6H5NO2, eine giftige, gelbe, ölige Flüssigkeit mit charakteristischem Bittermandelgeruch, entsteht leicht durch Nitrierung von Benzol (s.o.).
Pikrinsäure, C6H2(NO2)3OH, 2,4,6-Trinitrophenol, eine ziemlich starke Säure, entsteht u.a. durch Nitrierung von Phenol. Die in reinem Zustand ganz schwach gelblichen Kristalle von ausgesprochen bitterem Geschmack (pikros [gr.]= bitter) lösen sich nur mäßig gut in Wasser. In Lauge bildet sich das stark gelbe Pikrat-Ion, durch Zusatz von konz. Salpetersäure erhält man wieder eine beinahe farblose Lösung, die vorwiegend Pikrinsäuremoleküle enthält. Pikrinsäure wirkt daher also als Indikator; ihr Umschlagsgebiet liegt bei pH 0 bis 1.
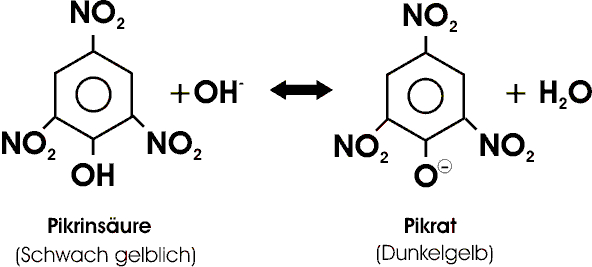
Als Säure vermag Pikrinsäure mit Eiweißen (Wolle, Haut) salzartige Verbindungen zu bilden und wirkt deshalb als Farbstoff. Bei raschem Erhitzen, unter Umständen auch auf Schlag, können sich Pikrinsäure und besonders auch ihre Salze explosionsartig zersetzen. Ammoniumpikrat wird deshalb als Sprengstoff verwendet (Melinit ).
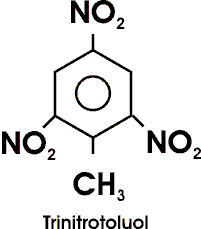 Trinitrotoluol, C6H2(NO2)3CH3, ist einer der wichtigsten Sprengstoffe (Trotyl ). TNT ist weniger wärme- und schlagempfindlich als Pikrinsäure und wird durch Initialzünder (Knallquecksilber, Bleiazid) zur Explosion gebracht.
Trinitrotoluol, C6H2(NO2)3CH3, ist einer der wichtigsten Sprengstoffe (Trotyl ). TNT ist weniger wärme- und schlagempfindlich als Pikrinsäure und wird durch Initialzünder (Knallquecksilber, Bleiazid) zur Explosion gebracht.
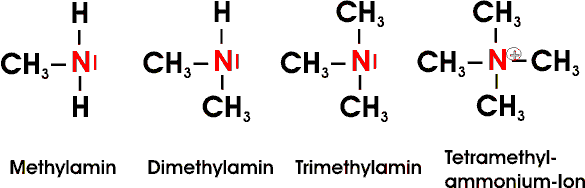
Mit Säuren bilden Amine wasserlösliche, zum Teil gut kristallisierende und beständige Salze:
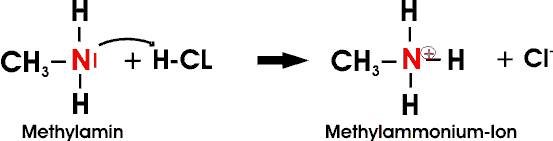
Auch Amine höherer Kohlenstoffzahl lösen sich deshalb gut in wäßrigen Säuren. Die niedrigen aliphatischen Amine sind flüchtige, unangenehm fischartig riechende Substanzen. Höhere Amine sind ölige und schlecht wasserlösliche Flüssigkeiten.
Infolge der schwach elektronenabstoßenden Wirkung der Alkylgruppen sind aliphatische Amine deutlich stärker basisch als Ammoniak. Aromatische Amine, wie z.B. Anilin (C6H5NH2), sind hingegen viel schwächere Basen: das freie Elektronenpaar des Stickstoffatoms tritt mit dem pi-Elektronensystem des aromatischen Ringes in Wechselwirkung; die Anlagerung eines Protons wird dadurch erschwert, der basische Charakter verringert. Dennoch löst sich das Anillin gut in Säuren unter Bildung eines Aniliniumions.
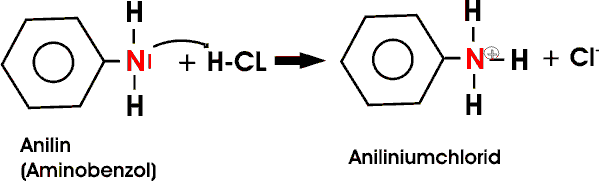
Aromatische Amine dienen als Ausgangsstoffe für viele Synthesen. Die Aminogruppe erleichtert die Substitution von Wasserstoffatomen des Rings durch elektrophile Teilchen. So entsteht bereits mit Bromwasser ein hellgelber Niederschlag von 2,4,6,-Tribromanilin. Daneben kann auch die Aminogruppe selbst an Reaktionen teilnehmen (Reaktion zu Diazoniumsalzen und Bildung von "Anilinfarben").
Anilin (Aminobenzol) findet sich in geringen Mengen in Steinkohleteer. Die technische Synthese geht vor allem von Nitrobenzol aus. Dieses kann mit Hilfe von Salzsäure und Eisenspänen oder unmittelbar mit Wasserstoff an geeigneten Katalysatoren reduziert werden.
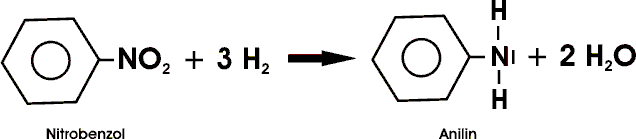
Bei höheren Temperaturen und unter Druck kann Anilin auch aus Monochlorbenzol und Ammoniak hergestellt werden.
BASF bedeutet übrigens Badische Anilin- und Soda-Fabriken.
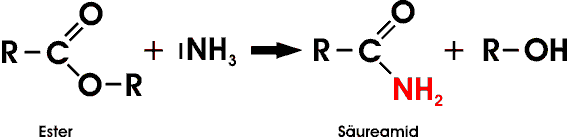
Dank der großen Elektronegativität der Carbonylgruppe wirken die Amide kaum basisch.
Ameisensäureamid (Formamid, Methansäureamid) findet ebenso wie sein Derivat Dimethylformamid (DMF) als Lösungsmittel Verwendung. Vom Ethansäureamid (Acetamid) an handelt es sich bei den Säureamiden um farblose, kristallisierte Feststoffe.
Zu den Amiden gehört auch der Harnstoff, der als Endprodukt des Eiweißabbaus im Harn ausgeschieden wird. Diese weiße, farb- und geruchlose Verbindung kann als Diamid der Kohlensäure aufgefaßt werden:
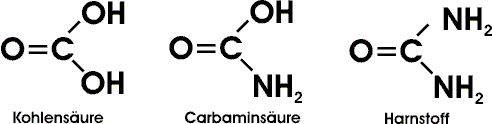
Durch Bakterien - ebenso durch Kochen mit Säuren oder Laugen - wird Harnstoff hydrolytisch gespalten:
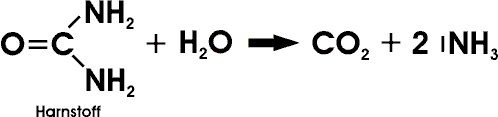
Harnstoff spielt als Bestandteil von Düngern (Stickstoffdünger), als Ausgangsstoff für Kunststoffe (Aminoplaste) und Arzneimittel (die als Schlafmittel verwendeten Barbiturate) eine große Rolle. Die technische Synthese geht - in Umkehrung der Hydrolysegleichung - von Kohlendioxid und Ammoniak aus, die unter Druck über das Ammoniumsalz der Carbaminsäure zum Harnstoff umgesetzt werden:
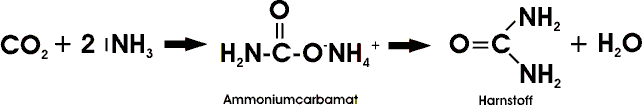
Beim Erwärmen kondensieren zwei Harnstoffmoleküle unter Ammoniakabgabe zu Biuret:
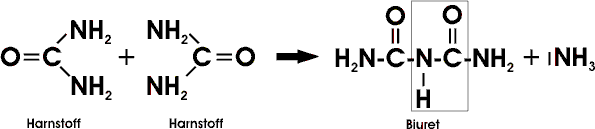
In alkalischer Lösung bildet Biuret mit Kupfer(II)-Salzen einen violetten Komplex. Die gleiche Biuret-Reaktion weisen auch Eiweißstoffe auf, da sie ebenfalls im Molekül die Gruppierung -NH-CO- (Peptidbindung ) aufweisen.
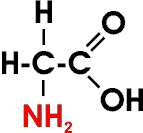
Aminosäuren sind chemisch gesehen Derivate der Carbonsäuren: In der Alkylgruppe ist mindestens ein Wasserstoffatom durch die Aminogruppe -NH2 ersetzt. Die einfachste Aminosäure ist die Aminoethansäure (Aminoessigsäure, Glycin):
Die Aminosäuren haben als Bausteine der Proteine (Eiweißstoffe) große Bedeutung und werden daher im Biochemie-Kapitel besprochen.
Durch Erhitzen von Benzol oder anderer aromatischen Verbindungen mit konz. Schwefelsäure erhält man Sulfonsäuren:
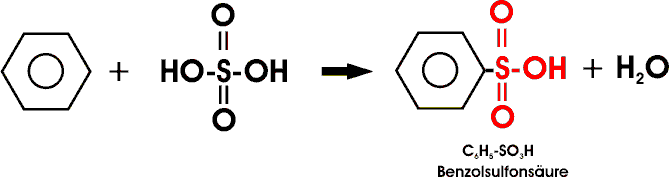
Benzolsulfonsäure ist eine hygroskopische (wasseranziehende), stark saure und gut wasserlösliche Substanz, die als Rohstoff synthetischer Waschmittel wichtig ist.