| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
Die Molekülformel oder Summenformel kann aber eindeutig festgelegt werden, wenn die molare Masse der Verbindung bekannt ist (über das molare Volumen).
Die chemischen und physikalischen Eigenschaften organischer Verbindungen werden nicht nur
durch die Art und Zahl der miteinander verknüpften Atome, sondern auch durch die Art dieser Verknüpfung
und die räumliche Anordnung der Atome, also durch die Struktur des Moleküls bestimmt.
Die Struktur oder Konstitution des Moleküls kann bei Verbindungen trotz gleicher Summenformel
sehr verschieden sein.
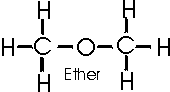
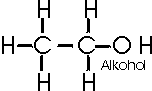
Beispielhaft hierfür stehen die stark unterschiedlichen Eigenschaften des Ethanols (Alkohol) und des Ethers (Methylether).
Die beide aus 2 C-Atomen, 6 H-Atomen und 1 O-Atom bestehen (C2H6O).
| Ethanol (Alkohol) | Methylether (Ether) | |
|---|---|---|
| Sdp. | 78°C | -25°C |
| Löslichkeit in Wasser | in jedem Verhältnis mischbar | 8g in 100g Wasser |
| Verhalten mit Natrium | bildet Wasserstoff | reagiert nicht mit Natrium |
Die Unterschiede in der Reaktion mit Natrium werden durch die Annahme verständlich, dass beim Alkohol eines der sechs Wasserstoffatome anders gebunden ist als die restlichen fünf Atome, beim Ether aber alle Wasserstoffatome gleichwertig sind.
Die Strukturformeln der beiden Verbindungen zeigen den Unterschied in der Verknüpfung der Atome:


Die Strukturformeln können vereinfacht werden:
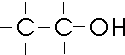
1. Bei der rationellen Formel werden einzelne Elemente zu rationellen Gruppen zusammengefasst:
2. Bei der Gerüstformel werden alle an Kohlenstoffatome gebundene Wasserstoffatome weggelassen; gelegentlich werden noch die Bindungsstriche gezeichnet (an deren Enden Wasserstoffatome zu denken sind):
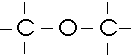
Für bestimmte Verbindungen, so für das Ethylen (Ethen, C2H4) oder das Acetylen (Ethin, C2H2) muß, um die Vierbindigkeit des Kohlenstoffes aufrecht zu erhalten, zwischen den C-Atomen eine Doppelbindung oder Dreifachbindung angenommen werden. In den üblichen Strukturformeln wird die Bindung durch einen Strich symbolisiert. Doppel- oder Dreifachbindungen werden durch zwei bzw. drei Striche symbolisiert:
![]()
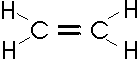
Einen wesentlichen Fortschritt in den Vorstellungen über die Natur dieser Bindungen brachte im Jahr 1916 der Vorschlag des Chemikers Lewis. Demnach erfolgt die Bindung in organischen Molekülen durch ein beiden Atomen gemeinsames Elektronenpaar oder - bei der Mehrfachbindung - durch mehrere gemeinsame Elektronenpaare. Mit Hilfe dieser (beiden Atomen zuzurechnenden) Elektronen erreichen die Atome der zweiten Periode (Kohlenstoff, Stickstoff, Sauerstoff und Fluor) ein Elektronenoktett wie das Atom des Edelgases Neon, der Wasserstoff ein Elektronendublett wie das Edelgas Helium. So besitzen im Methan (CH4) alle Atome eine "Edelgaskonfiguration"; daher ist für das Kohlenstoffatom die "Oktettregel" (umgeben von acht Valenzelektronen) erfüllt. Diese Art der Bindung wird Elektronenpaarbindung oder kovalente Bindung genannt.
Eine andere Möglichkeit, ein Elektronenoktett zu erreichen ist der Elektronenübergang zwischen zwei Atomen, der zur Bildung von Ionen und damit zur Ionenbindung führt.
Es gibt auch Moleküle die die Oktettregel nicht erfüllen. Es existieren Moleküle wie CH2 oder CH3, in denen der Kohlenstoff über ein freies Elektronenpaar bzw. ein einzelnes (einsames, freies ) Elektron besitzt. Solche Moleküle werden als Radikale bezeichnet.
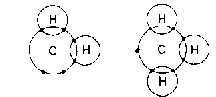
Diese Verbindungen, in denen der Kohlenstoff nicht über ein Elektronenoktett verfügt, sind sehr reaktiv und von kurzer Lebensdauer. Dagegen sind Moleküle in denen die Oktettregel erfüllt ist, besonders stabil und werden von den beteiligten Atomen bevorzugt "angestrebt".
- In einigen Verbindungen ist die Beschreibung der Molekülstruktur mit Hilfe einer Lewis-Formel nicht in befriedigender Weise möglich. Eine Lösung dieser Schwierigkeit bietet die Beschreibung der Molekülstruktur durch mehrere Strukturformeln, von denen jede für sich die Bedingungen der Lewis-Formel erfüllt. Nur die Gesamtheit dieser- gleichsam übereinander zu projizierenden - Grenzformeln beschreibt die Molekülstruktur:
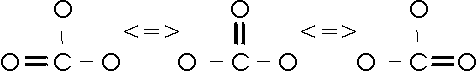
Wenn die Elektronenverteilung und damit die Molekülstruktur nur durch die Überlagerung mehrere (Lewis-) Grenzformeln dargestellt werden kann, spricht man von Mesomerie (oder Resonanz). Die verschiedenen Grenzformeln eines mesomeren Moleküls werden durch den Doppelpfeil <=> verbunden.
Ursache der Bindungspolarität sind die unterschiedlich starken Anziehungskräfte der Bindungspartner auf das bindende Elektronenpaar. Nahezu alle in organischen Verbindungen häufig auftretenden Verbindungen (C-O, C=O, O-H, C-Halogen) sind deutlich polar.
Eine polare Bindung bewirkt in einem linearen Molekül stets eine Molekülpolarität: Es liegt ein Dipol(molekül) vor, dessen Eigenschaften stark von denen unpolarer Verbindungen abweichen.
Zwischen unpolaren Molekülen wirken nur schwache Anziehungskräfte, die als Van der Waals-Kräfte
bezeichnet werden. Daher sind Verbindungen, die aus unpolaren Molekülen bestehen relativ flüchtig.
Die Van der Waals-Kräfte beruhen, ebenso wie die kovalente Bindung und die Ionenbindung,
auf der Anziehung zwischen entgegengesetzten elektrischen Ladungen. In einem Atom, etwa eines Edelgases,
oder einem Molekül, etwa von Wasserstoff oder Methan, bewegen sich die Elektronen innerhalb
bestimmter Räume um den Atomkern. Dabei kann während kurzer Zeit die Ladungsverteilung unsymetrisch werden,
so dass das Atom (Molekül) für einen Moment als Dipol mit positiver und negativer Seite erscheint.
Ist in diesem Augenblick ein anderes Atom (oder Molekül) in der Nähe, so werden dessen Elektronen in Richtung
der positiven Seite des ersten Atoms (oder Moleküls) verschoben. Dadurch wird auch das zweite Atom
(Molekül) zu einem Dipol. Weil ein solcher Dipol erst unter der Einwirkung des äußeren elektrischen
Feldes entsteht, nennt man ihn induzierten Dipol.
Van der Waals-Kräfte sind nichts anderes als elektrostatische Kräfte zwischen solchen induzierten Dipolen.
Da die Elektronen ständig in Bewegung sind, ändert sich die Ladungsverteilung in Atomen und Molekülen
fortwährend. Daher sind die Anziehungskräfte nur schwach. Sie werden um so größer, je größer die
Oberfläche der Partikel ist und je leichter die Ladungsverteilung in einem Teilchen polarisiert werden kann.
Beide Faktoren erklären die Zunahme der Van der Waals-Kräfte mit steigender Atom- bzw. Molekülmasse:
Größere Teilchen haben einerseits größere Oberflächen, andererseits werden die sich weiter vom Kern
entfernt bewegenden Elektronen von diesem weniger fest gebunden und sind daher leichter verschiebbar.
Moleküle können aber auch permanente Dipole darstellen. In diesen Fällen sind die Anziehungskräfte
zwischen den Dipolmolekülen wesentlich größer als die Van der Waals-Kräfte, weil
die Ladungsverteilung im Molekül dauernd unsymetrisch ist.
Die Dipolkräfte sind dann besonders wirksam, wenn ein Wasserstoffatom mit einem stark elektronegativen
Atom verbunden ist. Das dann positiv polarisierte Wasserstoffatom wirkt wegen seiner geringen Größe
auf ein anderes negativ polarisiertes Atom ganz besonders stark anziehend:
Für diese Fälle verwendet man die Bezeichnung Wasserstoffbrücke. Es handelt sich dabei nicht
um eine besondere Bindungsart, sondern lediglich um eine besonders stark ausgeprägte Dipolkraft.
Zwischen Dipolmolekülen und Ionen sind ebenfalls starke Wechselwirkungen möglich. Das Ion umhüllt
sich in einem polaren Lösungsmittel mit den Dipolmolekülen (Solvation). Handelt es sich bei dem
polaren Lösungsmittel um Wasser, so spricht man von Hydration (Hydrat-Hülle ! ).