| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
Unter Hydrolyse versteht man einen Vorgang, bei dem Kovalenzbindungen unter Aufnahme von Wasser gespalten werden.
in Grundbausteine zerlegen, die Monosaccharide genannt werden. Es sind vorwiegend Aldehyde oder Ketone mit zwei oder mehr Hydroxylgruppen. Diese niedermolekularen "Zucker" zeichnen sich durch ihren süßen Geschmack und durch ihre gute Wasserlöslichkeit aus. Wasserstoffbrücken bewirken starke zwischenmolekulare Kräfte in den Zuckerkristallen: Zucker sind feste und ziemlich harte Substanzen. Dagegen sind die innermolekularen Kräfte vergleichsweise schwach. Kohlenhydrate zersetzen sich beim Erhitzen unter Rußabscheidung, lassen sich also nicht unzersetzt destillieren, vielfach nicht einmal schmelzen.
Die Struktur kann aus folgenden experimentellen Befunden erschlossen werden:
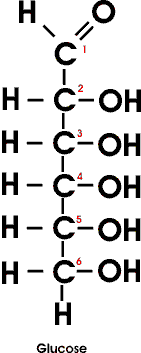
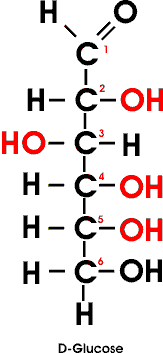
Glucose ist demnach eine Aldohexose oder allgemein eine "Aldose".
Die übliche Strukturformel vernachlässigt, dass jede der C-C-Bindungen einen Winkel von annähernd 110° einschließt. Es liegen weder die Atome der Kohlenstoffkette noch die der seitlichen Gruppen in einer Ebene. Die benutzte Strukturformel entsteht vielmehr durch Projektion der räumlichen Struktur in einer Ebene nach bestimmten Regeln.
Da das Zuckermolekül vier Chiralitätszentren (die C-Atome 2, 3, 4 und 5) aufweist, ist die Ableitung der Fischer Projektion komplizierter als bei dem Glycerinaldehyd.

Als Folge der vier Chiralitätszentren lassen sich bei der Hexose 24=16 zueinander stereoisomere Molekülstrukturen formulieren und auch als Verbindungen isolieren. In langwierigen Untersuchungen konnte nachgewiesen werden, dass die Glucose durch diese Projektionsformel zutreffend beschrieben wird.
Die abgeleitete "offene" oder Kettenformel steht mit zahlreichen Eigenschaften der Glucose in Widerspruch.
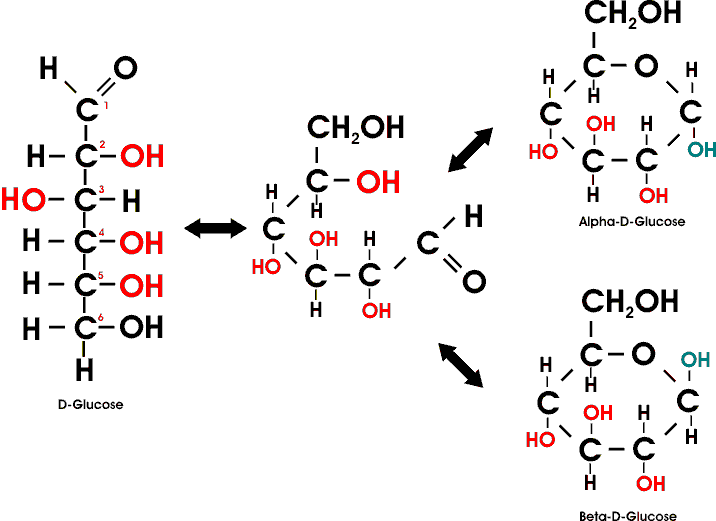
Die Umwandlung zwischen den beiden anomeren Ringformen erfolgt unter Protonenwanderung über die offenkettige Form mit ihrer freien Aldehydgruppe. Diese besitzt im Gleichgewicht eine sehr geringe Konzentration.
Die Glucose bildet also ein cyclisches Halbacetal. In kristalliner Form bildet die Glucose sechsgliedrige Ringmoleküle.
Beim Ringschluß bleiben die Tetraeder-Winkel erhalten. Der Ring ist nicht planar (flach). Er kann daher wie das Cyclohexan in mehreren Konformationen auftreten.
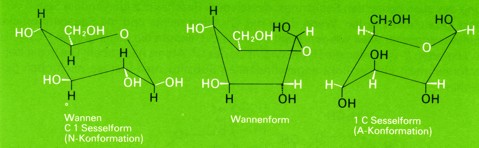
Die verschiedenen Konformationen sind nicht energiegleich: Die Sesselform ist energieärmer und daher gegenüber der Wannenform bevorzugt. Angestrebt wird zudem eine Konformation, bei der möglichst viele Seitenketten eine äquatoriale Lage einnehmen und damit größtmöglichen Abstand vom Kern besitzen. Dies ist in der "Normalform" (N-Konformation) der beta-D-Glucose der Fall.
Um die Strukturformeln zu vereinfachen, hat man sich darauf geeinigt nur die OH-Gruppen und die CH2OH-Gruppe an dem stilisierten Ring durch Striche anzudeuten. Wobei die Ausrichtung der Seitengruppen durch die Lage zum Ring deffiniert wird (nach oben oder nach unten).
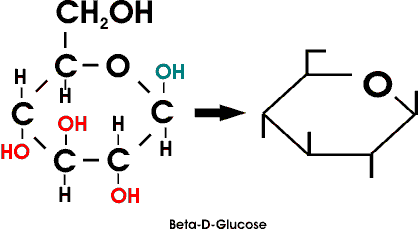
Allgemein ist bei Monosacchariden zu beobachten, dass die Ringe dann besonders stabil sind, wenn sich die sperrigen Substituenten (-CH2OH bzw. -OH) in der geräumigen äquatorialen Stellung befinden. Von den 16 möglichen Aldohexosen treten in den Naturstoffen nur wenig auf. In erster Linie sind diese die D-Glucose, dann noch D-Galaktose und D-Mannose mit je einer Hydroxylgruppe in axialer Stellung.
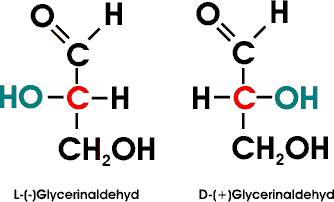
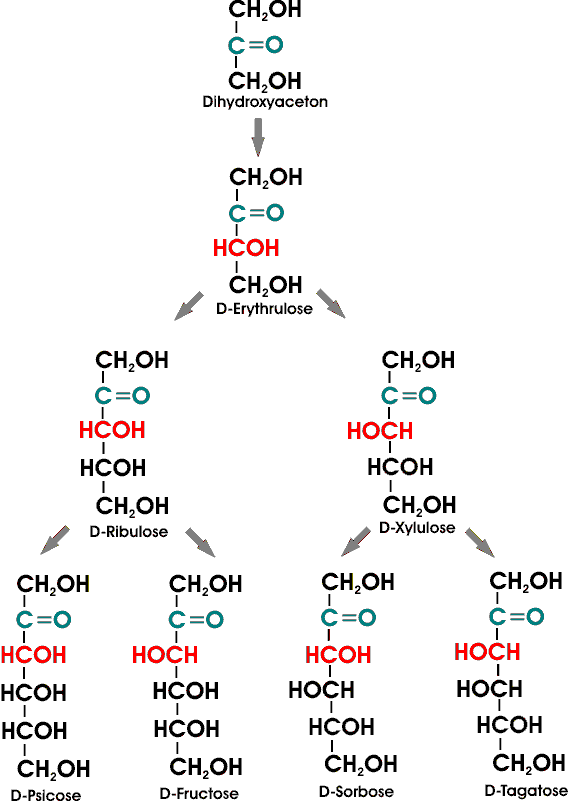
Das Glycerinaldehyd besitzt eine einziges asymetrisches C-Atom. Es gibt daher von dieser Aldose mit 3 Kohlenstoffatomen zwei Stereoisomere, die man als D-Glycerinaldehyd und als L-Glycerinaldehyd bezeichnet. Zucker mit 4, 5, oder 6 C-Atomen werden wie gewohnt (Nomenklatur der Alkane) als Tetrosen, Pentosen, Hexosen und Heptosen bezeichnet. Bei Kohlenhydraten, die mehr als ein asymetrisches C-Atom besitzen, beziehen sich die Symbole D und L auf dasjenige asymetrische C-Atom, das am weitesten von der Aldehyd- oder Ketogruppe entfernt ist. Wenn man das D-Glycerinaldehyd als Stammform ansieht, kann man durch Hinzufügung jeweils einer H-C-OH- bzw. HO-C-H-Gruppe einen Stammbaum der Aldosen aufbauen:
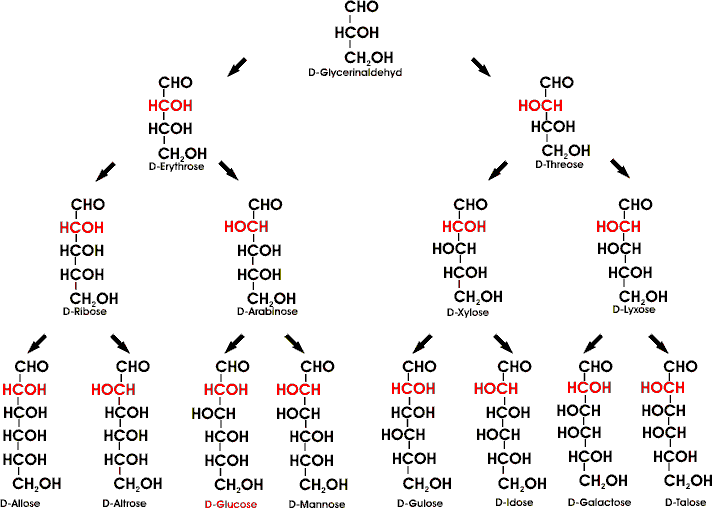
Man beachte, dass sich z.b. die D-Glucose und die D-Mannose nur in der Stellung am C-2 unterscheiden.
Solche Zucker, deren Konfiguration nur in einem einzigen asymetrischen Zentrum unterschiedlich ist, werden als Epimere bezeichnet. D-Glucose und D-Mannose sind also Epimere am C-2, D-Glucose und D-Galactose Epimere am C-4.
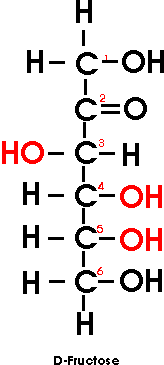
Trotz gleicher Summenformel (C6H12O6) zeigen sich im chemischen Verhalten deutliche Unterschiede zur Glucose. So bildet nur Fructose beim Erhitzen mit Resorcin in salzsaurer Lösung eine rote Verbindung (Seliwanowsche Reaktion).
Fructose besitzt in der offenkettigen Form eine Ketogruppe am C2-Atom.
Ein Teil der Moleküle geht aber auch in fünfgliedrige Halbketalringe über, die formal vom Furan abzuleiten sind. In dieser Fructofuranose-Form ist der Fruchtzucker in den zusammengesetzten Kohlenhydraten enthalten.
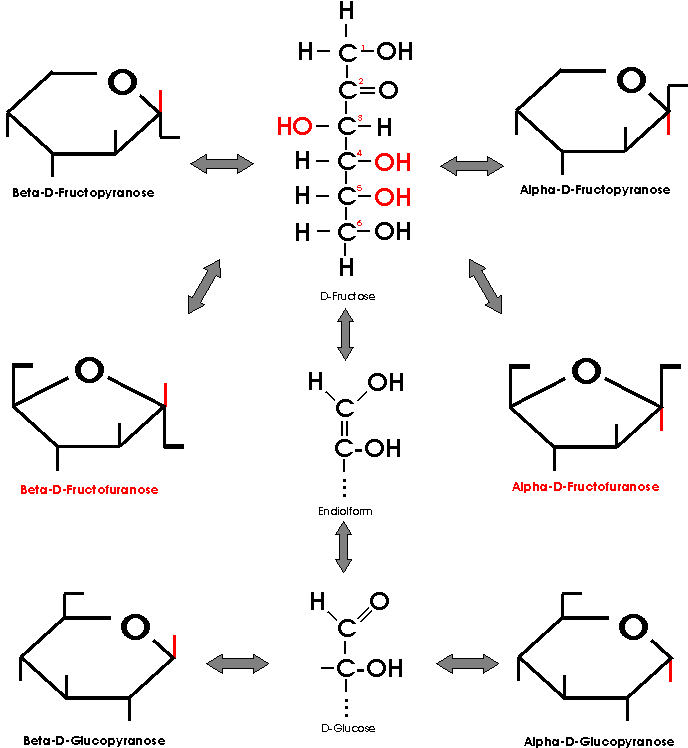
Im Gegensatz zu den Ketonen fallen bei den Ketosen Reduktionsproben wie die Fehlingsche Probe positiv aus. Zucker mit einer freien Aldehyd- oder Ketogruppe reduzieren Indikatoren zum Beispiel komplex gebundenes Cu2+ zu Cu+. Bei dieser Reaktion ist die offene Kettenform der Aldose oder Ketose das Reduktionsmittel. Ketosen können demnach leicht oxidiert werden. Die Ursache dieses überraschenden Verhaltens ist eine Umlagerung der Fructose über eine Endiol-Form in die Glucose, wobei der Zucker kurzzeitig offenkettig vorliegt. Hierbei handelt es sich um ein Beispiel für eine Keto-Enol-Tautomerie.

Erst durch hinzufügen einer weiteren asymetrischen Gruppe erreicht man eine Chiralität.
Fügt man die Gruppe HCOH (OH-Gruppe auf der rechten Seite) hinzu, kommt man zu der D-Erythrulose, die einzige D-Ketose mit vier C-Atomen. Auch hier gilt: Bei Kohlenhydraten, die mehr als ein asymetrisches C-Atom besitzen, beziehen sich die Symbole D und L auf dasjenige asymetrische C-Atom, das am weitesten von der Aldehyd- oder Ketogruppe entfernt ist.
Da Ketosen ein asymetrisches Zentrum weniger besitzen als Aldosen gibt es hier nur einen D-Vertreter mit vier C-Atomen.
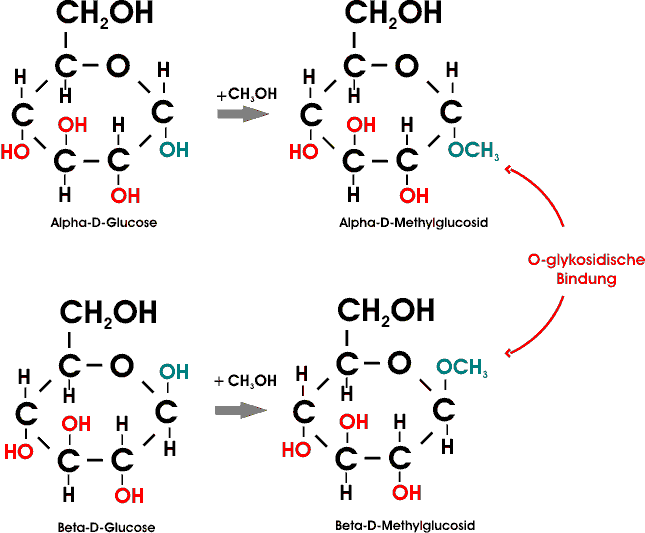
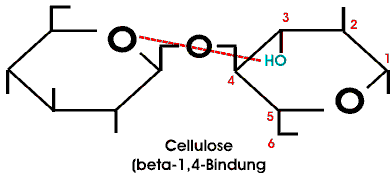
Die neue Bindung zwischen dem C-1 der Glucose und dem Sauerstoffatom des Methanols wird als O-glykosidische Bindung bezeichnet. Zucker können durch glykosidische Bindungen miteinander zu Di- und Polysacchariden verbunden werden. Zum Beispiel sind in der Cellulose D-Glucose-Einheiten über glykosidische Bindungen zwischen dem C-1 des einen Zuckers und dem Sauerstoffatom der C-4 OH-Gruppe des benachbarten Zuckers miteinander verknüpft.
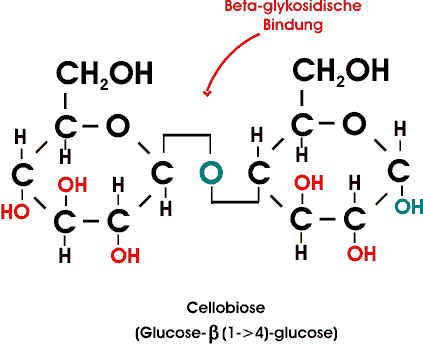
Die glykosidischen Bindungen in der Cellulose besitzen beta-Konfiguration. Die die vom C-1 ausgeht, liegt oberhalb der Ebene des Ringes. Die Glucose-Einheiten in der Cellulose sind also durch beta(1->4)-glykosidische Bindungen verknüpft, die man abgekürzt auch als beta1,4 oder beta-1,4 bezeichnet. Die einfache Verknüpfung aus zwei Glucose-Molekülen, also das Disaccharid, nennt sich Cellobiose.
Das anomere C-Atom eines Zuckers kann auch mit dem Stickstoffatom eines Amins durch eine N-glykosidische Bindung verknüpft sein. Die besondere Bedeutung dieses Typs glykosidischer Verbindung wird in solchen wichtigen Biomolekülen wie Nucleotiden, RNA und DNA offensichtlich. In nahezu allen natürlich vorkommenden Biomolekülen besitzt die N-glykosidische Bindung beta-Konfiguration.
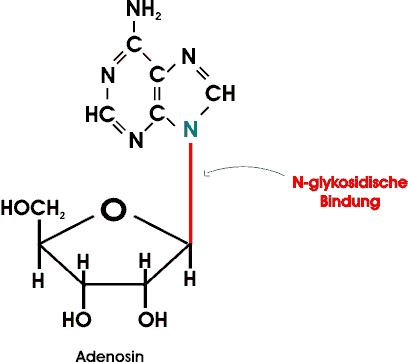
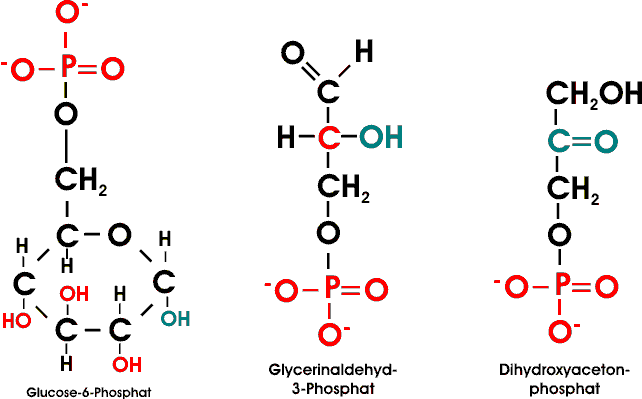
Eine andere Funktion der Phosphorylierung ist die Erzeugung reaktiver Zwischenformen zur Bildung von O- und N-glykosidischen Bindungen.
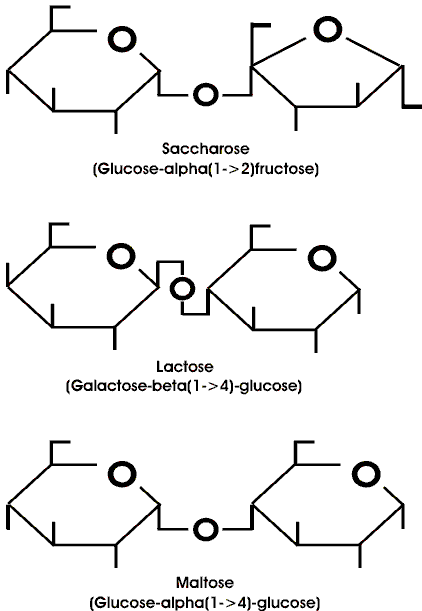
Die Saccharose (Rohrzucker) ist der gewöhnliche Tafelzucker und wird kommerziell aus Zuckerrohr oder Zuckerrüben hergestellt. Das anomere C-Atom einer Glucose ist hier alpha-glykosidisch mit dem einer Fructose verbunden. Daher besitzt die Saccharose keine freie reduzierende Gruppe (kein Aldehydende), im Gegensatz zu den meisten anderen Zuckern. Die Hydrolyse des Rorhrzuckers zu Glucose und Fructose wird durch die Saccharase (auch Invertase oder Fructofuranosidase genannt) katalysiert.
Die Lactose, ein Disaccharid, das in der Milch vorkommt (Milchzucker), besteht aus Galactose und Glucose in beta-1,4-glykosidischer Bindung. Im menschlichen Organismus wird sie durch die Lactose, in Bakterien durch die beta-Galaktosidase in diese beiden Zucker gespalten.
In der Maltose (Malzzucker) sind zwei Glucose-Einheiten durch eine alpha-1,4- glykosidische Bindung miteinander verknüpft. Die Maltose entsteht bei der Stärkehydrolyse und wird dann selbst durch die Maltase zu Glucose hydrolysiert.
Die Enzyme Saccharase, Lactase und Maltase befinden sich auf der äußeren Oberfläche der Mucosazellen des Dünndarms.
Fast alle Säuglinge und Kinder können Lactase verdauen. Dagegen fehlt den meisten Erwachsenen in bestimmten Bevölkerungsgruppen die Lactase, was eine Milchunverträglichkeit bewirkt. Ohne Lactase sammelt sich nach der Aufnahme von Milch die Lactose im Dünndarmlumen an, weil es keine Mechanismen für die Resorption (Aufnahme) dieses Saccharids gibt. Die große osmotische Wirkung der nicht resorbierten Lactose führt zum Einstrom von Flüssigkeit in den Dünndarm. Dadurch kommt es zu einem aufgetriebenen Leib, Übelkeit, Krämpfe, Schmerzen und wässrigem Durchfall. Der Lactasemangel scheint autosomal rezessiv vererbt zu werden und kommt gewöhnlich beim Jugendlichen und jungen Erwachsenen zum Durchbruch. Die Verbreitung des Lactasemangels in verschiedenen Populationen des Menschen variiert stark. zum Beispiel besitzen nur 3% der Dänen keine Lactase, verglichen mit 97% der Thais. Völker , bei denen die Erwachsenen keine Milch zu sich nehmen, haben im allgemeinen einen hohen Anteil an Lactoseintoleranz, die auch bei anderen Säugetieren vorkommt. Die Fähigkeit des Menschen, als Erwachsener Lactose zu verdauen , scheint sich seit der Domestizierung des Rindes vor etwa 10 000 Jahren entwickelt zu haben und ist eng an die Viehhaltung gekoppelt.
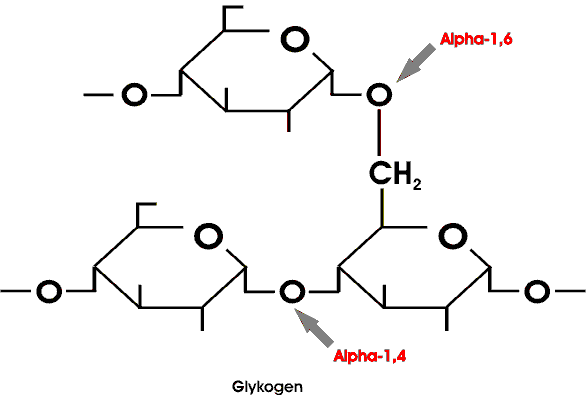
Diese Verzweigungen dienen zur Erhöhung der Löslichkeit des Glykogens und erleichtern die Mobilisierung seiner Zuckereinheiten.
Das Nährstoffreservoir der Pflanzen ist die Stärke, die in zwei Formen vorkommt. Die Amylose, die unverzweigte Form, besteht aus Glucoseeinheiten in alpha-1,4-Bindung. Das Amylopektin, die verzweigte Form, besitzt ungefähr eine alpha-1,6-Bindung auf ~ 30 alpha-1,4-Bindungen; abgesehen vom geringeren Verzweigungsgrad ist es damit dem Glykogen sehr ähnlich.
Mehr als die Hälfte der Kohlenhydrate, die der Mensch zu sich nimmt, ist Stärke. Sowohl Amylopektin als auch Amylose werden schnell durch die alpha-Amylase hydrolisiert, die von den Speicheldrüsen und der Bauchspeicheldrüse (Pankreas) sezerniert wird.
Dextrane sind Speicherpolysaccharide in Hefen und Bakterien und bestehen ebenfalls nur aus Glucoseeinheiten; sie unterscheiden sich aber vom Glykogen und von der Stärke dadurch, dass sie fast ausschließlich alpha-1,6-Bindungen enthalten. Abhängig von der untersuchten Spezies findet man mehr oder weniger Verzweigungen durch alpha-1,2-, alpha-1,3- und alpha-1,4-glykosidische Bindungen.
Durch parallel angeordnete Ketten entstehen Fibrillen.
Die alpha-1,4-Bindungen im Glykogen und in der Stärke rufen eine völlig andere molekulare Struktur hervor. Anstelle gerader Ketten bildet sich eine hohle Helix. Diese unterschiedlichen Folgen der alpha- und der beta-Bindungen besitzen biologische Bedeutung:
Die Exoskelette von Insekten und Krebsen enthalten Chitin, das aus N-Acetylglucosamin-Einheiten in beta-1,4-Bindungen besteht. Das Chitin bildet lange gerade Ketten, die eine strukturelle Aufgabe erfüllen. Chitin ähnelt also der Cellulose, mit dem Unterschied, dass der Substituent am C-2 keine Hydroxylgruppe, sondern eine acetylierte Aminogruppe.
Die Entfernung von Glykoproteinen aus dem Blut wird durch Oberflächenrezeptorproteinen auf Leberzellen erreicht. Die Oligosaccharid-Einheiten bestimmen letztlich die Zirkulationszeiten und zeigen an, wann das Protein, das sie trägt, aus dem Blutkreislauf genommen werden soll.
Pflanzen enthalten spezifische kohlenhydratbindende Proteine, die man als Lectine bezeichnet. Zum Beispiel bindet sich das Concanavalin A aus der Schwertbohne an innere und nicht reduzierende endständige Zuckerreste. Das Weizenkeimagglutinin, das Erdnußlecitin und das Phytohämagglutinin (aus der Feuerbohne) erkennen Disaccharide und Oligosaccharide. Alle bekannten Lectine enthalten zwei oder mehr Bindungsstellen für Kohlenhydrateinheiten, die für die Agglutination (Verklumpung) von roten Blutkörperchen (Erythrocyten) und anderen Zellen verantwortlich sind.
Bakterien können ebenfalls Lectine enthalten. Die Haftung von E.coli an die Epithelzellen des Darmes wird durch bakterielle Lektine vermittelt, die Oligosaccharideinheiten auf der Oberfläche von Zielzellen erkennen.
Kohlenhydrate sind vermutlich auch an der Vermittlung von Zell-Zell-Wechselwirkungen in Tieren beteiligt. Die Adhäsion von Neuronen bei der Entwicklung des Nervensystems wird zum Teil durch ein neurales Zelladhäsionsmolekül (N-CAM) vermittelt. Ein N-CAM-Molekül auf dem einen Neuron verbindet sich mit seinem Gegenstück auf einem anderen Neuron, um den Kontakt zwischen diesen beiden Zellen herzustellen und ihre dauerhafte Verbindung vorzubereiten.
Im 18.Jhr entdeckte der Berliner Chemiker Marggraf, dass die altbekannte Runkelrübe "nicht bloß ein zuckerähnliches Wesen" enthalte, sondern aus ihr "wahrer, vollkommener Zucker, dem bekannten aus Zuckerrohr völlig gleich" gewonnen werden kann. Die Entwicklung der Rübenzuckerindustrie wurde zu Beginn des 19.Jhr durch Napoleons Kontinentalsperre gefördert. Doch wurde der Rübenzucker gegenüber dem Rohrzucker erst voll konkurrenzfähig, als der Zuckergehalt der Zuckerrübe von 4,5% auf 16% gesteigert werden konnte.
Zur Zuckergewinnung werden die zerkleinerten Zuckerrüben mit heißem Wasser ausgelaugt. Der stark verunreinigte und daher dunkle Rohsaft enthält knapp 15% Zucker. Zur Abscheidung der Verunreinigungen wird ihm Kalkmilch (Ca(OH)2) zugesetzt, die mit diesen schwerlösliche Verbindungen bildet. Der Überschuß wird anschließend mit Kohlendioxid (Umsetzung zu Kalk) ausgefällt. Der gefilterte, hellgelbe Dünnsaft wird in der Hitze (in Verdampfern) eingedickt und schließlich im Vakuum nahezu eingedampft. Im dicken Sirup scheiden sich die Zuckerkristalle ab, von denen der anhaftende Sirup in der Zentrifuge großteils abgeschleudert und zuletzt mit Wasserdampf abgewaschen wird. Zur Abtrennung der letzten Verunreinigungen wird dieser Rohzucker in Wasser gelöst und dann nochmals eingekocht. So entsteht die Zuckerraffinade.
Cellulose ist im Holz enthalten. Mengenmäßig bedeutsame weitere Holbestandteile sind die Hemicellulosen (Polysaccharide, deren Monomere nicht Glucose, teilweise nicht einmal Hexosen sind) und die Lignine (Mischpolymerisate von Phenylpropenderivaten). Die Abtrennung der reinen Cellulose (Zellstoff) erfordert ein "Aufschließen", das heißt das Herauslösen dieser Nebenbestandteile.
Im Sulfidzellstoff-Verfahren, das in Deutschland durchgeführt wird, kocht man zerkleinertes Holz einige Stunden lang (bei 145°C und 5 bar Druck) mit einer Lösung von Calcium- und Magnesiumhydrogensulfit. Danach wird der ungelöste Rohzellstoff von der Kocherablauge abgetrennt, gebleicht, ausgewaschen, zerfasert, entwässert und zu Platten gepreßt.
Von der Zellstofferzeugung kann eine bedeutsame Umweltbelastung ausgehen. Die Produktion einer Tonne gebleichten Zellstoffs benötigt etwa 250 m3 Wasser, so dass die Abwässer die Vorfluter sehr stark belasten. Neue Verfahren die mit Sauerstoff bleichen sind wesentlich umweltverträglicher.
Im Viskoseverfahren werden die langen Cellulosenketten zunächst durch Laugen zerlegt. Mit Kohlenstoffdisulfid (CS2) enstehen anschließend Celluloseester, die sich in Natronlauge zur zähflüssiger Viskose lösen. Diese wird durch Spinndüsen in ein Säurebad gepreßt, wobei die Cellulose als Viscoseseide ("Reyon") wieder ausfällt. Zum Teil werden die Endlosfäden in kurze Stücke zerschnitten, die sich wie natürliche Fasern verspinnen lassen ("Zellwolle").
Beim Acetatverfahren verestert man die Cellulose mit Essigsäure, spaltet dann durch partielle Hydrolyse einen Teil der Acetatgruppen wieder ab und zerlegt gleichzeitig die langen Ketten in kürzere Bruchstücke. Wird dieses Celluloseacetat in Aceton gelöst und durch Spinndüsen in Heißluft gepreßt, so verdunstet das Lösungsmittel und es entsteht die Acetatseide.
Während also Viskoseseide und Zellwolle aus verkürzter, aber sonst unveränderter ("regenerierter") Cellulose bestehen, ist die Acetatfaser eine chemisch abgewandelte Cellulose. Gleiches gilt für das Cellulosenitrat, den fälschlich "Nitrocellulose" genannten Ester mit Salpetersäure. Nitrocellulose wird zu Schießbaumwolle oder zu Celluloid, einem der ältesten Kunststoffe, weiterverarbeitet.